Агонисты гпп 1
Агонисты гпп 1
Касымалиева Р., Шалаханова З. ,Сеитматова Г., Баймагамбетов А.
Во всем мире бремя диабета 2 типа продолжает прогрессивно увеличиваться, наряду с ростом ожирения и старения населения. Каждый год у 7 миллионов человек развивается сахарный диабет. Это увеличивает численность больных сахарным диабетом на 2 человека каждые 10 секунд.
Сахарный диабет является мультисистемным расстройством, связанным с почти двукратным превышением риска неблагоприятных сердечно-сосудистых исходов, включая ишемическую болезнь сердца, инсульт, и сердечно-сосудистую смертность. Сахарный диабет (СД) ассоциируется с высокой вероятностью развития сердечно-сосудистых осложнений у пациентов с ишемической болезнью сердца (ИБС): в 75% случаев именно она являются причиной госпитализаций, а в 80% случаев – фатальных исходов. Риск сердечно-сосудистых осложнений возрастает по мере нарастания ряда факторов риска, связанных с диабетом типа 2 (СД2), включая высокий уровень сахара в крови, избыточную массу тела, ожирение, высокое артериальное давление и нарушения липидного обмена. Только около 10 процентов людей с СД2 в состоянии контролировать все четыре из этих факторов риска, связанных с сердечно-сосудистыми заболеваниями. В ряде исследований было показано, что люди с диабетом имеют пожизненный риск развития инфаркта миокарда, что позволяет рассматривать сахарный диабет как “ишемической эквивалент болезни сердца.” По статистическим данным известно, что мужчины среднего возраста с диабетом живут на 6 лет меньше, женщины на 7 лет, по сравнению с пациентами без диабета. В случае сочетания СД 2 с сердечно-сосудистыми заболеваниями продолжительность жизни сокращается почти вдвое. С учетом масштаба развивающейся неинфекционной эпидемии СД, существует необходимость разработки патогенетически обусловленного, эффективного терапевтического алгоритма лечения, позволяющего достичь компенсации не только углеводного обмена, но и предупреждения микро и макрососудистых осложнений этого заболевания. При этом приоритетом в выборе терапевтических средств для лечения СД должна стать эффективность препаратов при их безопасности для пациентов.
Как известно, подавляющему большинству пациентов не удается достичь целевого уровня гликированного гемоглобина. Прогрессирующее снижение массы b-клеток, дислипидемия, нарушения в системе гемостаза, снижение резервов антиоксидантной системы, накопление свободных радикалов и как следствие хроническая гипергликемия запускают целый каскад неблагоприятных событий, завершающихся дисфункцией эндотелия, ранним атеросклеротическим поражением сосудов, обусловливающих высокий риск сердечно-сосудистых событий. Учитывая все вышесказанное, очевидно, что хотя достижение и поддержание стойкой нормогликемии приводит к предупреждению развития и замедлению прогрессирования микро и макрососудистых осложнений, с позиции современных представлений о долгосрочном контроле сахарного диабета, достижение лишь оптимального уровня гликемии является недостаточным. С этой точки зрения, появление и внедрение в практику препаратов класса инкретинов предоставляет новые возможности в управлении этим заболеванием .
В этом году исполнилось 112 лет «выдающемуся эксперименту», проведенному 16 января 1902 года Bayliss и Starling, в котором было показано, что при перерезке всех нервных связей между органами желудочно-кишечного тракта, введение кислоты в тонкий кишечник стимулирует секрецию поджелудочной железы. Термин «инкретин» впервые появился в 1932 г. В 1964 г. был впервые описан «инкретиновый эффект» в эксперименте, когда ответ со стороны секреции инсулина был более выраженным при пероральном применении глюкозы, чем при внутривенном ее введении. «Инкретиновый эффект» приводит к усилению глюкозозависимой секреции инсулина β-клетками поджелудочной железы и снижению продукции глюкагона α-клетками. Согласно оценкам M. Nauck et al., приблизительно 60-80 % инсулина, секретируемого в ответ на прием пищи, является следствием данного эффекта.
В 1986 г. обнаружено снижение эффекта инкретинов при СД2. Данные, указывающие на дефицит инкретинов при СД2, являются основанием для того, чтобы считать препараты, усиливающие инкреторный эффект, новым терапевтическим принципом в лечении диабета. Это обстоятельство диктует необходимость создания новых препаратов на основе использования эффектов гормонов-инкретинов, позволяющих не только устранять метаболические нарушения, но и сохранять функциональную активность клеток поджелудочной железы, стимулируя и активизируя физиологические механизмы глюкозозависимой секреции инсулина и подавления глюкагона.
Физиологические эффекты глюкагоноподобного пептида -1 (ГПП-1) реализуются после его взаимодействия со специфическими рецепторами, расположенными во многих органах и тканях, включая поджелудочную железу, желудок, тонкий кишечник, мозг, гипофиз, легкие, почки, сердце. Другим важным физиологическим эффектом ГПП-1 является его влияние на секрецию глюкагона. ГПП-1 глюкозозависимым механизмом подавляет секрецию глюкагона панкреатическими a-клетками. Последние исследования выявили следующие эффекты ГПП-1: увеличивает массу β-клеток и способствует дифференцировке клеток-предшественников протоков; подавляет апоптоз β-клеток. ГПП-1 замедляет скорость опорожнения желудка, связываясь с рецепторами в мозге и стимулируя парасимпатические нервы, что, в конечном счете, приводит к быстрому насыщению, подавлению аппетита и снижению массы тела. ГПП-1 так же имеет несколько эффектов на кардиоваскулярные параметры: сократительную функцию левого желудочка (клинические исследования показали положительные эффекты при неишемическом повреждении миокарда), применение ГПП-1 до и после ишемии уменьшает зону постишемического повреждения сердца, ГПП-1 снижают массу тела, АД, нормализуют липидограмму, ГПП-1 уменьшают эндотелиальную дисфункцию и демонстрирует положительные эффекты на моделях атеросклероза.
Единственным аналогом на 97% гомологичным к нативному ГПП-1 является лираглутид (Виктоза). Препарат Виктоза® был запущен в 2009 году и является доступным в более чем 60 странах по всему миру. В настоящее время более 750 000 пациентов получают препарат Виктоза® всему миру. В качестве нового класса противодиабетического лекарственного средства, он продемонстрировал, потенциальные кардиопротективные эффекты в обеих моделях, на животных и ранних клинических исследованиях. Долгосрочное, двойное слепое испытание LEADER было разработано для оценки итогов сердечно-сосудистых эффектов препарата Виктоза® по сравнению с плацебо, и в дополнение к терапии СД2. LEADER начато в сентябре 2010 года. 9340 пациентов из 410 центров 32 стран включены в это исследование. Средний возраст пациентов составил 64,3±7,2 лет, из них мужчин- 64,3%, индекс массы тела был 32,5±6,3 кг / м2. У 7592 (81,3%) обследуемых имелась ИБС в анамнезе. 1748 (18,7%) состояли в групп высокого риска, но в анамнезе ИБС не было. Ожидается, что LEADER обеспечит достоверные данные о сердечно-сосудистой безопасности терапии лираглутидом для пациентов с СД2.
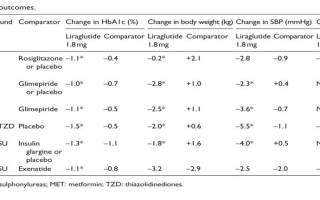
Эффективность и безопасность лираглутида была показана в шести рандомизированных контролируемых исследованиях (LEAD). Важно отметить, что факторы риска, способствующие сердечно-сосудистым заболеваниям, такие как ожирение, гипертония, дислипидемия, часто встречаются у больных СД2. Таким образом, антидиабетические схемы лечения в идеале должны сопровождаться благоприятными профилями сердечно-сосудистой безопасности и не приводить к увеличению массы тела. В программе LEAD были оценены риски сердечно-сосудистых осложнений при терапии лираглутидом, такие как масса тела, систолическое артериальное давление (САД), диастолическое артериальное давление (ДАД), частота сердечных сокращений (ЧСС) и сердечно-сосудистые события (аритмии, сердечная недостаточность, инфаркт миокарда или смерть). Каждый из этих конечных точек индивидуально рассмотрен для каждого из агонистов рецептора ГПП-1 и отражен в нижеприведенной таблице.
Было показано значительное снижение массы тела за счет потери висцерального жира при применении лираглутида в дозе 1,8 мг (LEAD 1-5). Известно, что контроль артериальной гипертензии позволяет снизить риск смерти от сердечно-сосудистых заболеваний у пациентов СД. Активация рецептора ГПП-1 может уменьшить почечную абсорбцию натрия. В шести исследованиях LEAD было показано снижение САД и ДАД у пациентов с СД2 при включении лираглутида в схему терапии. Другим биомаркером, связанным с риском ССЗ является липидный профиль. Мета-анализ всех шести испытаний LEAD показал, что, после 26 недель лечения, лираглутид значительно снизил уровень общего холестерина, триглицеридов, ЛПНП по сравнению с исходным (р Другие материалы в этой категории: « АНАЛИЗ ТЕЧЕНИЯ САХАРНОГО ДИАБЕТА У ПАЦИЕНТОВ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА ПО ДАННЫМ КАРДИОЛОГИЧЕСКОГО ОТДЕЛЕНИЯ ГКБ №1 Г. АЛМАТЫ ОЦЕНКА ФАКТОРОВ РИСКА РАЗВИТИЯ ДИАБЕТИЧЕСКОЙ ПОЛИНЕЙРОПАТИИ »
Агонисты гпп 1
Что такое инкретины?
В некоторых клетках тонкой кишки вырабатываются особые гормоны – инкретины. Главное их действие – повышение количества инсулина в крови в ответ на прием пищи. Выделяют несколько видов инкретинов. Для нас самым важным, пожалуй, является глюкагоноподобный пептид 1 типа (ГПП-1).
Как действует ГПП-1?
Стимуляция секреции инсулина зависит от уровня глюкозы крови. Если сахар крови выше нормальных значений, секреция инсулина будет усиливаться, в том числе и за счет действия ГПП-1. Но как только уровень сахара снижается до нормального уровня (примерно до 4,5 ммоль/л), данный эффект инкретинов исчезает. Поэтому гипогликемия возникнуть не может.
Помимо этого, ГПП-1 способствует образованию нового инсулина в клетках поджелудочной железы. Ряд экспериментальных работ на животных показал, что ГПП-1 «восстанавливает» те самые бета-клетки поджелудочной железы, что выделяют инсулин.
Глюкагон – гормон, также образующийся в клетках поджелудочной железы и противодействующий инсулину. Он увеличивает уровень сахара крови за счет выброса глюкозы из печени, где она была запасена в виде молекул гликогена, а также образования глюкозы из жиров и белков. Но если сахар в крови в пределах нормы, то этот эффект инкретинов также не реализуется.
Снижение моторики или сократительной способности органов пищеварения приводит к замедлению опорожнения желудка и всасывания глюкозы в кишечнике. В результате снижается уровень сахара после еды. Еще один плюс – чем больше ГПП-1, тем человек дольше чувствует насыщение.
В исследованиях с применением препаратов ГПП-1 было отмечено улучшение питания миокарда, кровотока в тканях за счет «расслабления» артерий, несущих кровь к сердечной мышце.
ГПП-1 снижает образование глюкозы из жиров и белков в печени, способствует «захвату» глюкозы из крови клетками мышц и печени.
ГПП-1 снижает интенсивность процессов, участвующих в разрушении костной ткани.
ГПП-1 действует на центр насыщения в головном мозге. В результате ощущение насыщения возникает быстрее, что приводит к уменьшению количества употребляемой пищи и, тем самым, к снижению веса
Что такое миметики инкретинов и зачем они нужны?
«Время жизни» инкретинов очень короткое – от 2 до 6 минут. После они разрушаются специальным ферментом – дипептидилпептидазой 4 типа (ДПП-4). Чтобы «продлить» действие инкретинов, были разработаны лекарства, похожие по структуре на ГПП-1, но не подвергающиеся воздействию ДПП-4. Таким образом, они могут действовать в организме намного дольше. Такие лекарства называются миметиками (mimetics, греч. mimetes — подражатель) инкретина или аналогами ГПП-1. Все инкретиномиметики вводятся подкожно с помощью специальной шприц-ручки. Техника введения напоминает таковую при использовании шприц-ручек с инсулином.
На данный момент в России используют следующие препараты аналогов ГПП-1 для лечения сахарного диабета 2 типа :
- Баета (эксенатид) – 2 раза в день, начиная с дозы по 5 мкг с последующим увеличением до 10 мкг утром и вечером;
- Виктоза (лираглутид) – 1 раз в день по 0,6 мг одну неделю, затем увеличение до 1,2 мг и, при необходимости, до 1,8 мг;
- Ликсумия (ликсизенатид) – по 10 и 20 мкг 1 раз в день;
- Трулисити (дулаглутид) 0,75 и 1,5 мг 1 раз в неделю.
Препараты Баета и Виктоза дольше всего применялись в РФ, остальные из них зарегистрированы для лечения СД 2 типа недавно. Активно исследуются и другие препараты данной группы, например, семаглутид. Часть из них уже применяется в некоторых странах Европы, например, особая форма экзенатида под торговым названием Будереон, который требует введения раз в неделю.
Лираглутид и его сравнение с другими препаратами
В крупном сравнительном исследовании LEAD (Liraglutide Effect and Action in Diabetes) действие лираглутида (Виктозы) сравнивалось с метформином, глимепиридом, росиглитазоном и плацебо. Применение лираглутида приводило к большему снижению уровня HbA1c, способствовало более значимому снижению веса. Ученые изучили также эффективность и безопасность комбинаций Виктозы с метформином, росиглитазоном и глимепиридом.
В исследовании LEAD-6 сопоставлялось действие эксенатида (Баеты) в дозе 10 мкг 2 раза в день и лираглутида в дозе 1,8 мкг в день. В группе, получавшей лираглутид, отмечалось более значимое снижение HbA1c, а также большее количество пациентов, достигших целевого уровня сахара крови.
Для лечения ожирения с успехом применяется препарат лираглутида в дозе 3 мг в сутки (Саксенда).
Лираглутид показал высокую эффективность при лечении неалкогольной жировой болезни печени в исследовании Lira-NAFLD.
Частые побочные эффекты инкретиномиметиков:
ГПП-1 строго противопоказаны при:
- беременности;
- сахарном диабете 1 типа;
- кетоацидозе;
- наличии панкреатита, рака поджелудочной железы;
- наличии медуллярного рака щитовидной железы в личном или семейном анамнезе;
- наличии синдрома множественной эндокринной неоплазии (МЭН);
- тяжелом поражении печени, почек.
Несомненные плюсы:
- высокая эффективность;
- снижение массы тела;
- минимальный риск гипогликемии.
Минусы:
- высокая цена;
- инъекционный путь введения.
Рекомендации по интенсификации сахароснижающей терапии СД 2-го типа
Карманные рекомендации для врачей по ведению пациентов
с сахарным диабетом и ожирением
Приложение к журналу «Медицинский совет»
М.В. Шестаковой, академика РАН, д.м.н., проф., директора Института диабета, заместителя директора ФГБУ «Эндокринологический научный центр» по научной работе
Специализированное издание, предназначенное для медицинских и фармацевтических работников.
Общие положения консенсуса РАЭ по инициации и интенсификации сахароснижающей терапии СД 2-го типа
1. Определение индивидуального целевого значения контроля гликемии по уровню НbА1с Для каждого пациента индивидуально устанавливается целевой уровень HbA1c, который зависит от возраста пациента или ожидаемой продолжительности его жизни, длительности заболевания, наличия сосудистых осложнений, риска развития гипогликемий.
На выбор индивидуальных целей HbA1c также могут оказывать влияние и другие факторы: мотивация, приверженность лечению, уровень образования пациента, использование других лекарственных средств.
2. Стратификация терапевтической тактики в зависимости от исходного уровня HbA1c
Совет экспертов РАЭ принял решение, что основным ориентиром в выборе стратегии лечения пациентов с СД 2-го типа должен являться показатель гликированного гемоглобина HbA1c, т. к. значения гликемии в течение суток имеют большую вариабельность. Показатели гликемии (натощак и постпрандиальные) могут быть использованы для принятия решений при невозможности получить результаты HbA1c (Приложение 1. Соответствие гликированного гемоглобина HbA1c среднесуточным показателям глюкозы плазмы).
- Изменение образа жизни (снижение массы тела при ее избытке, ограничение легкоусвояемых углеводов и насыщенных жиров, активизация физических нагрузок) является основой терапии СД 2-го типа при любом исходном уровне метаболического контроля. Обучение и мотивация больного должны начинаться незамедлительно. Тем не менее низкая приверженность данному немедикаментозному лечению диктует необходимость назначения лекарственной терапии. Поэтому терапия сахароснижающими препаратами в подавляющем большинстве случаев добавляется к изменению образа жизни уже в дебюте заболевания.
- При исходном HbA1c 6,5–7,5% достижение целевых значений гликемии возможно при использовании монотерапии сахароснижающими препаратами. Если при монотерапии достичь поставленных целей не удается, то в последующем возможно применение комбинированного лечения (два или три препарата).
- При исходном HbA1c 7,6–9,0% следует сразу начинать с комбинированной терапии. При неэффективности возможно применение сочетания трех сахароснижающих препаратов или инсулинотерапия.
- При исходном HbA1c более 9,0% при наличии выраженной клинической симптоматики (потеря массы тела, жажда, полиурия и др.) следует назначить инсулинотерапию (изолированную или в комбинации с ПССП). В дальнейшем, в случае достижения целевых показателей метаболического контроля, пациент может быть переведен на комбинированное лечение без инсулина. В случае отсутствия клинических симптомов декомпенсации в дебюте возможно назначение комбинации двух или трех сахароснижающих препаратов, воздействующих на разные механизмы развития гипергликемии.
Рисунок 1. Интенсификация сахароснижающей терапии при исходном значении HbA1c до 7,5% Алгоритмы специализированной медицинской помощи больным сахарным диабетом, 8-й выпуск, 2017 г.
Принятие решения об изменении (интенсификации) ранее назначенной терапии
- Мониторинг эффективности сахароснижающей терапии по уровню НbА1с рекомендуется осуществлять каждые 3 мес. Титрация дозы назначенных сахароснижающих препаратов до максимально эффективной (переносимой) осуществляется по данным самоконтроля гликемии.
- Изменение (интенсификация) сахароснижающей терапии при ее неэффективности (т. е. при отсутствии достижения индивидуальных целей НbА1с) должно быть выполнено не позднее чем через 6 мес.; в случае ухудшения самочувствия или при отсутствии признаков эффективности лечения решение об интенсификации может быть принято раньше.
- Безопасность и эффективность являются приоритетами в выборе лечения. Индивидуальный подход должен применяться как на старте терапии, так и на любом этапе лечения.
Наиболее часто используемыми группами сахароснижающих препаратов являются бигуаниды, ингибиторы дипептидилпептидазы 4-го типа (иДПП-4), ингибиторы натрийзависимого глюкозного котранспортера 2-го типа (иНГЛТ-2), агонисты ГПП-1, производные СМ, тиазолидиндионы (ТЗД), инсулины. К более редко используемым группам препаратов относятся глиниды и ингибиторы α-глюкозидазы.
Рисунок 2. Фармакотерапия сахарного диабета 2-го типа
Согласно Алгоритмам специализированной медицинской помощи больным СД, монотерапия ПССП может быть назначена в дебюте заболевания при уровне HbA1c
- Имеется в виду наличие хотя бы одного из следующих заболеваний и/или состояний: ИБС (инфаркт миокарда в анамнезе, шунтирование/стентирование коронарных артерий, ИБС с поражением одного или нескольких коронарных сосудов); ишемический или геморрагический инсульт в анамнезе; заболевания периферических артерий (с симптоматикой или без).
- По данным исследования EMPA-REG OUTCOME.
- Исследования сердечно-сосудистых и почечных аспектов безопасности других препаратов класса иНГЛТ-2 продолжаются. Источник: Алгоритмы специализированной медицинской помощи больным сахарным диабетом, 8-й выпуск / под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. М., Сахарный диабет, 2017, 20(1S): 1-12
Другие главы из книги:
© Все права защищены. Никакая часть данной книги не может быть воспроизведена в какой бы то ни было форме без письменного разрешения владельцев авторских прав.
Ольга Бондур
Жизнь с диабетом
Главное меню
Популярное
Новые публикации
ГЛЮКАГОНОПОДОБНЫЙ ПЕПТИД-1
ГЛЮКАГОНОПОДОБНЫЙ ПЕПТИД-1: ОТ ФИЗИОЛОГИИ К ЭФФЕКТИВНОМУ УПРАВЛЕНИЮ САХАРНЫМ ДИАБЕТОМ 2 ТИПА
Несмотря на большие достижения в управлении сахарным диабетом 2 типа (СД2), в этой области медицины по-прежнему сохраняются нерешенные проблемы и имеется потребность в новых эффективных стратегиях лечения. Традиционные пероральные сахароснижающие препараты (ПССП), используемые в повседневной клинической практике, такие как метформин, производные сульфонилмочевины (ПСМ) и тиозолидиндионы, имеют ограниченные возможности в предотвращении прогрессирования СД2. Кроме тог, большинство ПСМ способствуют увеличению массы тела, повышают риск гипогликемий и ускоряют прогрессирование функциональной недостаточности β-клеток. В отличие от ПСМ метформин позволяет большинству пациентов избегать прибавки массы тела и гипогликемий. Именно поэтому он рассматривается как препарат первого выбора больными СД2 при отсутствии противопоказаний к его применению и непереносимости. Однако в целом, как и другие ПССП, метформин не способен поддерживать необходимый уровень контроля в течение длительного времени. В этом плане внедрение в клиническую практику инновационных лекарственных препаратов приобретает особое значение.
Инкретиновые гормоны
Научные разработки последних лет позволили досконально изучить роль инкретиновых гормонов в регуляции метаболизма углеводов в организме человека и их влияние на β-клетку. Терапия на основе инкретинов влияет не только на гликемический контроль. Возможно, она воздействует на функцию β-клеток и может способствовать замедлению потери их функциональной активности или даже ее восстановлению. Инкретиновые гормоны- глюкагоноподобный пептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП), вырабатываются в желудочно-кишечном тракте в ответ на прием пищи. Рецепторы к ГПП-1 достаточно широко представлены в различных органах: в α- и β-клетках поджелудочной железы, различных отделах желудочно-кишечного тракта, центральной и периферической нервной системах, в сердечной мышце, почках, печени. Поэтому в дополнение к глюкозависимой стимуляции секреции инсулина активация рецепторов к ГПП-1 ведет и к подавлению секреции глюкагона, замедлению опорожнения желудка, снижению аппетита/повышению чувства сытости, а также к положительным эффектам на сердечно-сосудистую и центральную нервную систему. Общепринято представление о СД2 как о неуклонно прогрессирующем заболевании. В классическом исследовании UKPDS (UK Prospective Diabets Study) было подтверждено, что на момент верификации диагноза СД2 функциональная активность β-клеток снижена в среднем наполовину. Кроме того, результаты многочисленных проспективных исследований показывают, что параллельно ухудшению гликемического контроля снижается функциональный резерв β-клеток.
Лираглутид (Виктоза) – первый аналог природного человеческого ГПП-1 длительного действия, соответствующий природному ГПП-1. Агонисты ГПП-1 эксенатид и лираглутид в многочисленных проспективных рандомизированных контролируемых исследованиях продемонстрировали клинически значимое дозозависимое долгосрочное улучшение всех основных параметров гликемического контроля (HbA1c, глюкозы крови натощак и постпрондиальной гликемии) при низком риске гипогликемии, а также значительное стабильное снижение массы тела и систолического артериального давления. Кроме того, результаты клинических исследований подтвердили, что терапия агонистами ГПП-1 сопровождается улучшением функции β-клеток. Это подтверждается исследованиями с использованием гомеостатической модели функции β-клеток поджелудочной железы (НОМА) и оценкой соотношения инсулина к проинсулину. Терапия обоими агонистами ГПП-1 сопровождалась улучшением функции β-клеток, что характеризовалось повышением уровня инсулина натощак. Кроме того, терапия лираглутидом показала достоверно лучшую переносимость с меньшей частотой развития побочных эффектов (тошноты) и гипогликемий.
Практические рекомендации по применению препарата лираглутид
Лираглутид (Виктоза) может быть использован для инициации терапии СД2, а также для улучшения гликемического контроля в составе комбинированной терапии с одним или двумя ПССП. Согласно рекомендациям по применению, начальная доза лираглутида составляет 0,6 мг/сут, что позволяет избегать или минимизировать возможность развития нежелательных явлений (тошноты). Препарат вводится подкожно в область живота, бедра или плеча 1 раз в сутки в любое время независимо от приема пищи. Через неделю дозу лираглутида повышают до 1,2 мг/сут, а при необходимости – до 1,8 мг/сут. Коррекция дозы лираглутида не требует проведения ежедневного самоконтроля гликемии. Лираглутид вводится с помощью предварительно заполненной шприц-ручки с использованием игл длиной до 8 мм и толщиной до 32 G, что делает инъекцию безболезненной. После начала использования шприц-ручка не требует специальных условий хранения (возможно хранение при комнатной температуре). Так как лираглутид практически полностью метаболизируется эндогенно, его можно применять при лечении больных с легким или умеренным нарушением функции почек, при этом коррекции дозы не требуется.
Согласно консенсусу AACE/ACE по лечению СД2, а также Российским алгоритмам специализированной медицинской помощи больным СД, агонистам ГПП-1 отводится важная роль как на этапе начала терапии СД2, так и при ее интенсификации за счет комбинации с 1-2 ПССП для улучшения гликемического контроля у пациентов, не достигших поставленных целей на фоне предшествовавшей терапии. Терапия препаратами, использующими инкретиновый эффект, особенно рекомендуется в тех случаях, когда дальнейшая интенсификация сахароснижающей терапии сопряжена с высоким риском гипогликемии или увеличением массы тела. По сравнению с другими доступными сегодня препаратми группы инкретинов лираглутид (Виктоза) имеет высокую клиническую эффективность и безопасность.
Инкретиномиметики в терапии сахарного диабета 2-го типа
В патогенезе сахарного диабета 2-го типа (СД 2-го типа) можно выделить три основных механизма:
1) резистентность инсулинозависимых тканей к действию инсулина;
2) нарушение секреции инсулина поджелудочной железой;
3) избыточная продукция глюкозы печенью.
Дефекты aльфа- и бета-клеток островков Лангерганса ответственны за развитие этого заболевания. Бета-клетки производят инсулин, который стимулирует поглощение глюкозы тканями. При СД 2-го типа нарушение их функции вызывает недостаточный синтез инсулина, что ведет к развитию гипергликемии. Альфа-клетки производят глюкагон, повышенная концентрация которого приводит к увеличению высвобождения глюкозы в печени. При СД 2-го типа избыточная секреция глюкагона и пониженная секреция инсулина вызывают увеличение выброса глюкозы из печени и ведут к гипергликемии.
лавной целью лечения СД 2-го типа было и остается достижение стабильной и длительной (в течение всей жизни пациента) компенсации углеводного обмена. Результаты многочисленных международных исследований доказывают, что именно компенсация заболевания является основой профилактики тяжелых осложнений, повышения продолжительности и качества жизни больных.
Международная диабетическая федерация (IDF) разработала рекомендации по оценке риска сосудистых осложнений (табл. 1). Эти рекомендации являются стратегической целью, исходя из которой можно ставить задачи по улучшению компенсации заболевания.
Тем не менее, несмотря на многочисленные преимущества активного гликемического контроля, высокое качество и разнообразие современных сахароснижающих препаратов, достижение стойкой компенсации диабета и сегодня представляет значительные трудности. У многих пациентов с СД 2-го типа назначение пероральных сахароснижающих препаратов (ПССП) не позволяет добиться необходимого контроля гликемии. По данным известного исследования UKPDS, степень компенсации, необходимая для профилактики развития микроангиопатий, достигалась через 3 года после постановки диагноза при монотерапии ПССП только у 45% больных, а через 6 лет — у 30%.
Это обстоятельство диктует необходимость создания новых препаратов, позволяющих не только устранять метаболические нарушения, но и сохранять функциональную активность клеток поджелудочной железы, стимулируя и активизируя физиологические механизмы регуляции секреции инсулина и содержания глюкозы крови.
Регуляция гомеостаза глюкозы в организме осуществляется сложной полигормональной системой, включающей гормоны поджелудочной железы и гормоны инкретины, вырабатываемые в кишечнике в ответ на прием пищи. До 70% постпрандиальной секреции инсулина у здоровых людей обусловлено именно эффектом инкретинов (рис. 1) [6, 22]. У больных СД 2-го типа этот эффект значительно снижен (рис. 2).
Гормонами, играющими основную роль в инсулиновом ответе на прием пищи (инкретинами), являются глюкозозависимый инсулинотропный полипептид (ГИП) и глюкагоноподобный пептид-1 (ГПП-1).
Поступление пищи в пищеварительный тракт быстро стимулирует выброс ГИП и ГПП-1. Совместно эти гормоны приводят в действие механизмы, представленные в табл. 2.
Инкретины могут снижать уровень гликемии за счет «неинсулиновых» механизмов путем замедления опорожнения желудка и снижения потребления пищи. При СД 2-го типа содержание инкретинов и их эффект снижен, а уровень глюкозы в крови повышен. Тем не менее, действие инкретинов возможно восстановить у таких пациентов путем введения экзогенных препаратов инкретина, которые способны нормализовать индуцированную глюкозой секрецию инсулина [23]. Способность ГПП-1 вызывать улучшение показателей гликемического контроля представляет определенный интерес в плане лечения СД 2-го типа.
Результатом выяснения роли желудочно-кишечных гормонов (инкретинов) в регуляции углеводного обмена явилось создание принципиально нового класса сахароснижающих препаратов — инкретиномиметиков.
К инкретиномиметикам, используемым в терапии СД 2-го типа, относятся два класса препаратов: агонисты ГПП-1 (эксенатид, лираглутид) и ингибиторы дипептидилпептидазы ДПП-4 (ситаглиптин, вилдаглиптин).
Эксенатид (Баета) был выделен из слюны гигантской ящерицы Gila monster. Аминокислотная последовательность эксенатида на 50% совпадает с человеческим ГПП-1. Исследования in vitro показали, что препарат связывается с рецепторами к ГПП-1 и устойчив к инактивации ДПП-4. Кроме того, при подкожном введении эксенатида пациентам с СД 2-го типа пик концентрации в плазме достигался через 2–3 часа, а период полужизни составлял 2–6 часов. Эти фармакологические свойства эксенатида позволяют проводить терапию данным препаратом в виде двух подкожных инъекций в день перед завтраком и перед ужином, что достаточно эффективно снижает уровень гликемии на протяжении всех суток. Таким образом, лечение эксенатидом может рассматриваться как в качестве монотерапии СД 2-го типа, так и в составе комбинированной сахароснижающей терапии.
Изучение эффективности эксенатида проводилось в ряде международных исследований.
Так, было проведено многоцентровое исследование III фазы по изучению эффективности терапии эксенатидом и плацебо в сочетании с метформином, препаратами сульфонилмочевины или их комбинацией. Исследование продолжалось 30 недель и включало 1446 пациентов с неудовлетворительной компенсацией диабета на предшествующей терапии ПССП в суб- или максимальных дозах. Средний исходный уровень HbА1с составил 8,4 ± 1,1% (норма до 6%). По окончании 4-недельного начального плацебо-периода, пациенты тройным слепым методом рандомизировались для получения плацебо или эксенатида в дозах 5 и 10 мкг дважды в день подкожно за 15 минут перед завтраком и ужином. В качестве первичной конечной точки оценивали уровень HbА1с, показатели постпрандиальной и тощаковой гликемии (ГКМ), уровни базального инсулина и проинсулина, массу тела и количество пациентов, достигнувших HbА1с ≤ 7%. Статистически достоверное улучшение показателей углеводного обмена отмечалось во всех группах пациентов, получавших эксенатид. Максимальный эффект был достигнут на приеме эксенатида в дозе 10 мкг как по уровню HbА1с, так и по другим показателям, в том числе по снижению веса. Достоверные изменения HbА1с были получены уже через 4 недели после начала лечения. Среднее снижение уровня HbА1с составило: 0,4–0,55% при дозе эксенатида 5 мкг и 0,77–0,86% — при дозе 10 мкг; в группе плацебо этот показатель увеличился на 0,08–0,23%.
Достоверного влияния на эффективность эксенатида в зависимости от сопутствующей терапии выявлено не было, за исключением показателей веса и глюкозы натощак, которые снижались более значимо в подгруппах, получавших метформин и его комбинацию с препаратами сульфонилмочевины. Снижение веса отмечалось даже у тех пациентов, которые получали препараты сульфонилмочевины, терапия которыми обычно ассоциирована с увеличением массы тела. Показательно, что снижение веса отмечалось вне зависимости от наличия и выраженности побочных явлений — тошноты и рвоты и было достоверным даже у тех пациентов, которые не испытывали побочных реакций. По окончании 30 недель лечения пациенты могли продолжить участие в открытой фазе исследования, где в течение 4 недель получали эксенатид в дозе 5 мкг, а далее в дозе 10 мкг два раза в день в сочетании с исходной пероральной терапией. Результаты оценивались на 52-й и 82-й неделе. К 82-й неделе значимое снижение уровня HbА1с было достигнуто у всех пациентов, в том числе у получавших плацебо в течение первых 30 недель. В группах, продолжавших получать эксенатид, уровень HbА1с оставался стабильным и отмечалось дальнейшее снижение уровня гликемии натощак и веса. Среди пациентов, получавших 10 мкг эксенатида, уровень HbА1с ≤ 7% наблюдался у 62% пациентов. При сочетании эксенатида и метформина к 82 неделе лечения отмечалось достоверное снижение общего холестерина, триглицеридов, липополисахариды низкой плотности (ЛПНП), аполипопротеина В и повышение уровня липополисахаридов высокой плотности (ЛПВП) (табл. 3).
Большие возможности в лечении СД 2-го типа связывают с новой лекарственной формой эксенатида длительного высвобождения (Эксенатид-ЛАР *). Данная форма препарата позволяет применять его в режиме одной инъекции в неделю с достижением как выраженного сахароснижающего эффекта (снижение уровня HbA1c на 1,4–2,0%), так и уменьшения массы тела в среднем на 4 кг. В исследовании Эксенатид-ЛАР участвовало 45 пациентов с СД 2-го типа, у которых не было достигнуто компенсации на фоне приема метформина и соблюдения субкалорийной диеты. Эксенатид-ЛАР назначался в дозах 0,8 мг и 2,0 мг в виде подкожных инъекций 1 раз в неделю на протяжении 15 недель. Исходно уровень HbA1c составлял 9,2 ± 2,1%, уровень ГКМ 10,6 ± 3,6 ммоль/л, индекс массы тела (ИМТ) 29,2 ± 1,5 кг/м2. В конце исследования было выявлено снижение уровня HbA1c на 1,4% для дозы Эксенатида-ЛАР 0,8 мг и на 1,7% для дозы 2,0 мг. Снижение уровня HbA1c менее 7% было зафиксировано у 86% пациентов, получавших Эксенатид-ЛАР в дозе 2,0 мг. Снижение уровня ГКМ в среднем составило 2,2 ± 0,5 ммоль/л. У пациентов, получавших Эксенатид-ЛАР в дозе 2,0 мг, через 15 недель отмечалось снижение массы тела в среднем на 3,8 ± 1,4 кг. У пациентов, получавших Эксенатид-ЛАР в дозе 0,8 мг, снижения массы тела не отмечено [20].
Наш опыт применения эксенатида (Баеты) основывается на наблюдательном исследовании, которое проводилось в Эндокринологическом диспансере Департамента здравоохранения города Москвы и включало 36 больных СД 2-го типа (9 мужчин и 27 женщин), получавших Баету в течение 6 месяцев. Средний возраст участников составил 58,6 ± 6,7 года (47–76 лет), продолжительность заболевания — 9,1 ± 1,1 года (2–22 года). Все пациенты с периода манифестации СД находились на комбинированной терапии таблетированными препаратами (Манинил + Глюкофаж) в субмаксимальных и максимальных дозах. Исходно: средняя масса тела 92,4 ± 14,5 кг (71–125 кг), средний индекс массы тела 33,42 ± 4,98 кг/м2 (25–44 кг/м2), соотношение объема талии и объема бедер (ОТ/ОБ) — 0,99 ± 0,08. У большинства пациентов жировая ткань была распределена по абдоминальному типу.
Изучалось содержание общего холестерина, триглицеридов, холестерина ЛПВП, холестерина ЛПНП, ТГ, гликемии натощак, С-пептида, инсулина, проинсулина, резистина, адипонектина в сыворотке крови. Уровень инсулинорезистентности оценивали с помощью индекса HOMA-ИР, функциональную активность бета-клеток по индексу HOMA-ФБ. Всем пациентам проводилось исследование с использованием двухэнергетической рентгеновской абсорбциометрии на аппарате Лунар ДПХ ПРО. Результаты исследования представлены в табл. 4.