Инсулин молекулярная масса
Инсулин
Инсулин, получивший свое название от наименования панкреатических островков (лат. insula – островок), был первым белком, первичная структура которого была раскрыта в 1954 г. Ф. Сэнджером (см. главу 1). В чистом виде инсулин был получен в 1922 г. после его обнаружения в экстрактах панкреатических островков Ф. Бантингом и Ч. Бестом. Молекула инсулина, содержащая 51 аминокислотный остаток, состоит из двух полипептидных цепей, соединенных между собой в двух точках дисульфидными мостиками. Строение инсулина и его предшественника проинсулина приведено в главе 1 (см. рис. 1.14). В настоящее время принято обозначать цепью А инсулина 21-членный пептид и цепью В – пептид, содержащий 30 остатков аминокислот. Во многих лабораториях осуществлен, кроме того, химический синтез инсулина. Наиболее близким по своей структуре к инсулину человека является инсулин свиньи, у которого в цепи В вместо треонина в положении 30 содержится аланин.
Существенных различий в аминокислотной последовательности в инсулине от разных животных нет. Инсулины различаются аминокислотным составом цепи А в положениях 8–10.
Согласно современным представлениям, биосинтез инсулина осуществляется в β-клетках панкреатических островков из своего предшественника проинсулина, впервые выделенного Д. Стайнером в 1966 г. В настоящее время не только выяснена первичная структура проинсулина, но и осуществлен его химический синтез (см. рис. 1.14). Проинсулин представлен одной полипептидной цепью, содержащей 84 аминокислотных остатка; он лишен биологической, т.е. гормональной, активности. Местом синтеза проинсули-на считается фракция микросом β-клеток панкреатических островков; превращение неактивного проинсулина в активный инсулин (наиболее существенная часть синтеза) происходит при перемещении проинсулина от рибосом к секреторным гранулам путем частичного протеолиза (отщепление с С-конца полипептидной цепи пептида, содержащего 33 аминокислотных остатка и получившего наименование соединяющего пептида, или С-пепти-да). Длина и первичная структура С-пептида подвержена большим изменениям у разных видов животных, чем последовательность цепей А и В инсулина. Установлено, что исходным предшественником инсулина является препроинсулин, содержащий, помимо проинсулина, его так называемую лидерную, или сигнальную, последовательность на N-конце, состоящую из 23 остатков аминокислот; при образовании молекулы проинсулина этот сигнальный пептид отщепляется специальной пептидазой. Далее молекула проинсулина также подвергается частичному протеолизу, и под действием трипсиноподобной протеиназы отщепляются по две основные аминокислоты с N- и С-конца пептида С – соответственно дипептиды Aрг–Aрг и Лиз– –Aрг (см. рис. 1.14). Однако природа ферментов и тонкие механизмы этого важного биологического процесса – образование активной молекулы инсулина окончательно не выяснены.
Синтезированный из проинсулина инсулин может существовать в нескольких формах, различающихся по биологическим, иммунологическим и физико-химическим свойствам. Различают две формы инсулина: 1) свободную, вступающую во взаимодействие с антителами, полученными к кристаллическому инсулину, и стимулирующую усвоение глюкозы мышечной и жировой тканями; 2) связанную, не реагирующую с антителами и активную только в отношении жировой ткани. В настоящее время доказано существование связанной формы инсулина и установлена локализация ее в белковых фракциях сыворотки крови, в частности в области трансферринов и α-глобулинов. Молекулярная масса связанного инсулина от 60000 до 100000. Различают, кроме того, так называемую форму А инсулина, отличающуюся от двух предыдущих рядом физико-химических и биологических свойств, занимающую промежуточное положение и появляющуюся в ответ на быструю, срочную потребность организма в инсулине.
В физиологической регуляции синтеза инсулина доминирующую роль играет концентрация глюкозы в крови. Так, повышение содержания глюкозы в крови вызывает увеличение секреции инсулина в панкреатических островках, а снижение ее содержания, наоборот,– замедление секреции инсулина. Этот феномен контроля по типу обратной связи рассматривается как один из важнейших механизмов регуляции содержания глюкозы в крови. На секрецию инсулина оказывают влияние, кроме того, электролиты (особенно ионы кальция), аминокислоты, глюкагон и секретин. Приводятся доказательства роли циклазной системы в секреции инсулина. Предполагают, что глюкоза действует в качестве сигнала для активирования аденилат-циклазы, а образовавшийся в этой системе цАМФ – в качестве сигнала для секреции инсулина.
При недостаточной секреции (точнее, недостаточном синтезе) инсулина развивается специфическое заболевание – сахарный диабет (см. главу 10). Помимо клинически выявляемых симптомов (полиурия, полидипсия и полифагия), сахарный диабет характеризуется рядом специфических нарушений процессов обмена. Так, у больных развиваются гипергликемия (увеличение уровня глюкозы в крови) и гликозурия (выделение глюкозы с мочой, в которой в норме она отсутствует). К расстройствам обмена относят также усиленный распад гликогена в печени и мышцах, замедление биосинтеза белков и жиров, снижение скорости окисления глюкозы в тканях, развитие отрицательного азотистого баланса, увеличение содержания холестерина и других липидов в крови. При диабете усиливаются мобилизация жиров из депо, синтез углеводов из аминокислот (глюконеогенез) и избыточный синтез кетоновых тел (кетонурия). После введения больным инсулина все перечисленные нарушения, как правило, исчезают, однако действие гормона ограничено во времени, поэтому необходимо вводить его постоянно. Клинические симптомы и метаболические нарушения при сахарном диабете могут быть объяснены не только отсутствием синтеза инсулина. Получены доказательства, что при второй форме сахарного диабета, так называемой инсулинрезистентной, имеют место и молекулярные дефекты: в частности, нарушение структуры инсулина или нарушение ферментативного превращения проинсулина в инсулин. В основе развития этой формы диабета часто лежит потеря рецепторами клеток-мишеней способности соединяться с молекулой инсулина, синтез которого нарушен, или синтез мутантного рецептора (см. далее).
У экспериментальных животных введение инсулина вызывает гипогликемию (снижение уровня глюкозы в крови), увеличение запасов гликогена в мышцах, усиление анаболических процессов, повышение скорости утилизации глюкозы в тканях. Кроме того, инсулин оказывает опосредованное влияние на водный и минеральный обмен.
Механизм действия инсулина окончательно не расшифрован, несмотря на огромное количество фактических данных, свидетельствующих о существовании тесной и прямой зависимости между инсулином и процессами обмена веществ в организме. В соответствии с «унитарной» теорией все эффекты инсулина вызваны его влиянием на обмен глюкозы через фермент гексокиназу. Новые экспериментальные данные свидетельствуют, что усиление и стимуляция инсулином таких процессов, как транспорт ионов и аминокислот, трансляция и синтез белка, экспрессия генов и др., являются независимыми. Это послужило основанием для предположения о множественных механизмах действия инсулина.
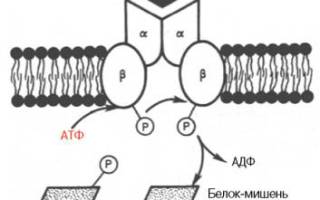
Рис. 8.1. Инсулиновый рецептор (схема). Две α-цепи на наружной поверхности мембраны клетки и две трансмембранные β-цепи. Связывание инсулина с α-цепями запускает аутофосфорилирование остатков тирозина в β-цепях; активный тирозинкиназный домен затем участвует в фосфорилировании неактивных белков-мишеней в цитозоле.
Наиболее вероятной в настоящее время представляется мембранная локализация первичного действия почти всех белковых гормонов, включая инсулин. Получены доказательства существования специфического рецептора инсулина на внешней плазматической мембране почти всех клеток организма, а также образования инсулинрецепторного комплекса. Рецептор синтезируется в виде предшественника – полипептида (1382 аминокислотных остатка, мол. масса 190000), который далее расщепляется на α-и β-субъединицы, т.е. на гетеродимер (в формуле α2–β2), связанные дисульфидными связями. Оказалось, что если α-субъединицы (мол. масса 135000) почти целиком располагаются на внешней стороне биомембраны, выполняя функцию связывания инсулина клетки, то β-субъединицы (мол. масса 95000) представляют собой трансмембранный белок, выполняющий функцию преобразования сигнала (рис. 8.1). Концентрация рецепторов инсулина на поверхности достигает 20000 на клетку, и период их полужизни составляет 7–12 ч.
Самым интересным свойством рецептора инсулина, отличным от всех других рецепторов гормонов белковой и пептидной природы, является его способность аутофосфорилирования, т.е. когда рецептор наделен сам протеинкиназной (тирозинкиназной) активностью. При связывании инсулина с α-цепями рецептора происходит активирование тирозинкиназной активности β-цепей путем фосфорилирования их тирозиновых остатков. В свою очередь активная тирозинкиназа β-цепей запускает каскад фосфо-рилирования–дефосфорилирования протеинкиназ, в частности мембранных или цитозольных серин- или треонинкиназ, т.е. протеинкиназ и белков-мишеней, фосфорилирование в которых осуществляется за счет ОН-групп серина и треонина. Соответственно имеют место изменения клеточной активности, в частности активация и ингибирование ферментов, транспорт глюкозы, синтез полимерных молекул нуклеиновых кислот и белков и т.д . Следует подчеркнуть, однако, что тонкие молекулярные механизмы путей передачи сигнала от инсулинрецепторного комплекса на множество внутриклеточных процессов пока не раскрыты. Вполне возможно участие в подобных процессах ряда внутриклеточных вторичных мессенджеров, в частности циклических нуклеотидов, производных фосфатидилинозитолов и др. Нельзя исключить, кроме того, возможности существования внутриклеточного посредника или медиатора действия инсулина (особого внутриклеточного рецептора), контролирующего транскрипцию генов и соответственно синтез мРНК. Предполагают, что действием инсулина и участием в регуляции экспрессии генов или в транскрипции специфических мРНК может быть объяснена его роль в таких фундаментальных процессах жизнедеятельности, как эмбриогенез и дифференцировка клеток высших организмов.
Инсулин – самый молодой гормон
Строение
Инсулин представляет собой белок, состоящий из двух пептидных цепей А (21 аминокислота) и В (30 аминокислот), связанных между собой дисульфидными мостиками. Всего в зрелом инсулине человека присутствует 51 аминокислота и его молекулярная масса равна 5,7 кДа.
Синтез
Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи.
На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для “созревания” гормона . По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn 2+ .
Схема синтеза инсулина
Регуляция синтеза и секреции
Секреция инсулина происходит постоянно, и около 50% инсулина, высвобождаемого из β-клеток, никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
- первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
- вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация глюкозы, тем большее число β-клеток подключается к секреции инсулина.
Индукция синтеза инсулина происходит от момента проникновения глюкозы в клетку до трансляции инсулиновой мРНК. Она регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой мРНК и увеличением трансляции инсулиновой мРНК.
Активация секреции инсулина
1. После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе),
2. Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3. В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4. Накопление АТФ стимулирует закрытие ионных K + -каналов, что приводит к деполяризации мембраны,
5. Деполяризация мембраны приводит к открытию потенциал-зависимых Ca 2+ -каналов и притоку ионов Ca 2+ в клетку,
6. Поступающие ионы Ca 2+ активируют фосфолипазу C и запускают кальций-фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол-трифосфата (ИФ3),
7. Появление ИФ3 в цитозоле открывает Ca 2+ -каналы в эндоплазматической сети, что ускоряет накопление ионов Ca 2+ в цитозоле,
8. Резкое увеличение концентрации в клетке ионов Ca 2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9. Далее происходит распад кристаллов, отделение ионов Zn 2+ и выход молекул активного инсулина в кровоток.
Схема внутриклеточной регуляции секреции инсулина при участии глюкозы
Описанный ведущий механизм может корректироваться в ту или иную сторону под действием ряда других факторов, таких как аминокислоты, жирные кислоты, гормоны ЖКТ и другие гормоны, нервная регуляция .
Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенциируют действие глюкозы.
Свободные жирные кислоты также являются факторами, стимулирующими секрецию инсулина, но тоже только в присутствии глюкозы. При гипогликемии они оказывают обратный эффект, подавляя экспрессию гена инсулина.
Логичной является положительная чувствительность секреции инсулина к действию гормонов желудочно-кишечного тракта – инкретинов (энтероглюкагона и глюкозозависимого инсулинотропного полипептида), холецистокинина, секретина, гастрина, желудочного ингибирующего полипептида.
Клинически важным и в какой-то мере опасным является усиление секреции инсулина при длительном воздействии соматотропного гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов. При этом возрастает риск истощения β-клеток, уменьшение синтеза инсулина и возникновение инсулинзависимого сахарного диабета. Такое может наблюдаться при использовании указанных гормонов в терапии или при патологиях, связанных с их гиперфункцией.
Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки, гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция β2-адренорецепторов приводит к усилению секреции.
Также выделение инсулина повышается n.vagus, в свою очередь находящегося под контролем гипоталамуса, чувствительного к концентрации глюкозы крови.
Мишени
Рецепторы инсулина находятся практически на всех клетках организма, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. последний просто не проникает через гематоэнцефалический барьер.
Механизм действия
После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки – субстраты инсулинового рецептора. Дальнейшее развитие событий обусловлено двумя направлениями: MAP-киназный путь и ФИ-3-киназный механизмы действия (подробно).
При активации фосфатидилинозитол-3-киназного механизма результатом являются быстрые эффекты – активация ГлюТ-4 и поступление глюкозы в клетку, изменение активности “метаболических” ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
При реализации MAP-киназного механизма (англ. MAP – mitogen-activated protein) регулируются медленные эффекты – пролиферация и дифференцировка клеток, процессы апоптоза и антиапоптоза.
Два механизма действия инсулина
Скорость эффектов действия инсулина
Биологические эффекты инсулина подразделяются по скорости развития:
Очень быстрые эффекты (секунды)
Эти эффекты связаны с изменением трансмембранных транспортов :
1. Активации Na + /K + -АТФазы , что вызывает выход ионов Na + и вход в клетку ионов K + , что ведет к гиперполяризации мембран чувствительных к инсулину клеток (кроме гепатоцитов).
2. Активация Na + /H + -обменника на цитоплазматической мембране многих клеток и выход из клетки ионов H + в обмен на ионы Na + . Такое влияние имеет значение в патогенезе артериальной гипертензии при сахарном диабете 2 типа.
3. Угнетение мембранной Ca 2+ -АТФазы приводит к задержке ионов Ca 2+ в цитозоле клетки.
4. Выход на мембрану миоцитов и адипоцитов переносчиков глюкозы ГлюТ-4 и увеличение в 20-50 раз объема транспорта глюкозы в клетку.
Быстрые эффекты (минуты)
Быстрые эффекты заключаются в изменении скоростей фосфорилирования и дефосфорилирования метаболических ферментов и регуляторных белков.
Печень
- торможение эффектов адреналина и глюкагона (фосфодиэстераза),
- ускорение гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиление синтеза жирных кислот (ацетил-SКоА-карбоксилаза),
- формирование ЛПОНП,
- повышение синтеза холестерина (ГМГ-SКоА-редуктаза),
Мышцы
- торможение эффектов адреналина (фосфодиэстераза),
- стимулирует транспорт глюкозы в клетки (активация ГлюТ-4),
- стимуляция гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиливает транспорт нейтральных аминокислот в мышцы,
- стимулирует трансляцию (рибосомальный синтез белков).
Жировая ткань
- стимулирует транспорт глюкозы в клетки (активация Глют-4),
- активирует запасание жирных кислот в тканях (липопротеинлипаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы),
- создание возможности для запасания ТАГ (инактивация гормон-чувствительной-липазы).
Медленные эффекты (минуты-часы)
Медленные эффекты заключаются в изменении скорости транскрипции генов белков, отвечающих за обмен веществ, за рост и деление клеток, например:
1. Индукция синтеза ферментов в печени
- глюкокиназы и пируваткиназы ( гликолиз ),
- АТФ-цитрат-лиазы, ацетил-SКоА-карбоксилазы, синтазы жирных кислот, цитозольной малатдегидрогеназы ( синтез жирных кислот ),
- глюкозо-6-фосфатдегидрогеназы ( пентозофосфатный путь ),
2. Индукция в адипоцитах синтеза глицеральдегидфосфат-дегидрогеназы и синтазы жирных кислот.
3. Репрессия синтеза мРНК, например, для ФЕП-карбоксикиназы ( глюконеогенез ).
4. Обеспечивает процессы трансляции, повышая фосфорилирование по серину рибосомального белка S6.
Очень медленные эффекты (часы-сутки)
Очень медленные эффекты реализуют митогенез и размножение клеток. Например, к этим эффектам относится
1. Повышение в печени синтеза соматомедина, зависимого от гормона роста.
2. Увеличение роста и пролиферации клеток в синергизме с соматомединами.
3. Переход клетки из G1-фазы в S-фазу клеточного цикла.
Инактивация инсулина
Удаление инсулина из циркуляции происходит после его связывания с рецептором и последующей интернализации (эндоцитоза) гормон-рецепторного комплекса, в основном в печени и мышцах. После поглощения комплекс разрушается и белковые молекулы лизируются до свободных аминокислот. В печени захватывается и разрушается до 50% инсулина при первом прохождении крови, оттекающей от поджелудочной железы. В почках инсулин фильтруется в первичную мочу и, после реабсорбции в проксимальных канальцах, разрушается.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Инсулин – самый молодой гормон
Строение
Инсулин представляет собой белок, состоящий из двух пептидных цепей А (21 аминокислота) и В (30 аминокислот), связанных между собой дисульфидными мостиками. Всего в зрелом инсулине человека присутствует 51 аминокислота и его молекулярная масса равна 5,7 кДа.
Синтез
Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи.
На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для “созревания” гормона . По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn 2+ .
Схема синтеза инсулина
Регуляция синтеза и секреции
Секреция инсулина происходит постоянно, и около 50% инсулина, высвобождаемого из β-клеток, никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
- первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
- вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация глюкозы, тем большее число β-клеток подключается к секреции инсулина.
Индукция синтеза инсулина происходит от момента проникновения глюкозы в клетку до трансляции инсулиновой мРНК. Она регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой мРНК и увеличением трансляции инсулиновой мРНК.
Активация секреции инсулина
1. После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе),
2. Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3. В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4. Накопление АТФ стимулирует закрытие ионных K + -каналов, что приводит к деполяризации мембраны,
5. Деполяризация мембраны приводит к открытию потенциал-зависимых Ca 2+ -каналов и притоку ионов Ca 2+ в клетку,
6. Поступающие ионы Ca 2+ активируют фосфолипазу C и запускают кальций-фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол-трифосфата (ИФ3),
7. Появление ИФ3 в цитозоле открывает Ca 2+ -каналы в эндоплазматической сети, что ускоряет накопление ионов Ca 2+ в цитозоле,
8. Резкое увеличение концентрации в клетке ионов Ca 2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9. Далее происходит распад кристаллов, отделение ионов Zn 2+ и выход молекул активного инсулина в кровоток.
Схема внутриклеточной регуляции секреции инсулина при участии глюкозы
Описанный ведущий механизм может корректироваться в ту или иную сторону под действием ряда других факторов, таких как аминокислоты, жирные кислоты, гормоны ЖКТ и другие гормоны, нервная регуляция .
Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенциируют действие глюкозы.
Свободные жирные кислоты также являются факторами, стимулирующими секрецию инсулина, но тоже только в присутствии глюкозы. При гипогликемии они оказывают обратный эффект, подавляя экспрессию гена инсулина.
Логичной является положительная чувствительность секреции инсулина к действию гормонов желудочно-кишечного тракта – инкретинов (энтероглюкагона и глюкозозависимого инсулинотропного полипептида), холецистокинина, секретина, гастрина, желудочного ингибирующего полипептида.
Клинически важным и в какой-то мере опасным является усиление секреции инсулина при длительном воздействии соматотропного гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов. При этом возрастает риск истощения β-клеток, уменьшение синтеза инсулина и возникновение инсулинзависимого сахарного диабета. Такое может наблюдаться при использовании указанных гормонов в терапии или при патологиях, связанных с их гиперфункцией.
Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки, гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция β2-адренорецепторов приводит к усилению секреции.
Также выделение инсулина повышается n.vagus, в свою очередь находящегося под контролем гипоталамуса, чувствительного к концентрации глюкозы крови.
Мишени
Рецепторы инсулина находятся практически на всех клетках организма, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. последний просто не проникает через гематоэнцефалический барьер.
Механизм действия
После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки – субстраты инсулинового рецептора. Дальнейшее развитие событий обусловлено двумя направлениями: MAP-киназный путь и ФИ-3-киназный механизмы действия (подробно).
При активации фосфатидилинозитол-3-киназного механизма результатом являются быстрые эффекты – активация ГлюТ-4 и поступление глюкозы в клетку, изменение активности “метаболических” ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
При реализации MAP-киназного механизма (англ. MAP – mitogen-activated protein) регулируются медленные эффекты – пролиферация и дифференцировка клеток, процессы апоптоза и антиапоптоза.
Два механизма действия инсулина
Скорость эффектов действия инсулина
Биологические эффекты инсулина подразделяются по скорости развития:
Очень быстрые эффекты (секунды)
Эти эффекты связаны с изменением трансмембранных транспортов :
1. Активации Na + /K + -АТФазы , что вызывает выход ионов Na + и вход в клетку ионов K + , что ведет к гиперполяризации мембран чувствительных к инсулину клеток (кроме гепатоцитов).
2. Активация Na + /H + -обменника на цитоплазматической мембране многих клеток и выход из клетки ионов H + в обмен на ионы Na + . Такое влияние имеет значение в патогенезе артериальной гипертензии при сахарном диабете 2 типа.
3. Угнетение мембранной Ca 2+ -АТФазы приводит к задержке ионов Ca 2+ в цитозоле клетки.
4. Выход на мембрану миоцитов и адипоцитов переносчиков глюкозы ГлюТ-4 и увеличение в 20-50 раз объема транспорта глюкозы в клетку.
Быстрые эффекты (минуты)
Быстрые эффекты заключаются в изменении скоростей фосфорилирования и дефосфорилирования метаболических ферментов и регуляторных белков.
Печень
- торможение эффектов адреналина и глюкагона (фосфодиэстераза),
- ускорение гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиление синтеза жирных кислот (ацетил-SКоА-карбоксилаза),
- формирование ЛПОНП,
- повышение синтеза холестерина (ГМГ-SКоА-редуктаза),
Мышцы
- торможение эффектов адреналина (фосфодиэстераза),
- стимулирует транспорт глюкозы в клетки (активация ГлюТ-4),
- стимуляция гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиливает транспорт нейтральных аминокислот в мышцы,
- стимулирует трансляцию (рибосомальный синтез белков).
Жировая ткань
- стимулирует транспорт глюкозы в клетки (активация Глют-4),
- активирует запасание жирных кислот в тканях (липопротеинлипаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы),
- создание возможности для запасания ТАГ (инактивация гормон-чувствительной-липазы).
Медленные эффекты (минуты-часы)
Медленные эффекты заключаются в изменении скорости транскрипции генов белков, отвечающих за обмен веществ, за рост и деление клеток, например:
1. Индукция синтеза ферментов в печени
- глюкокиназы и пируваткиназы ( гликолиз ),
- АТФ-цитрат-лиазы, ацетил-SКоА-карбоксилазы, синтазы жирных кислот, цитозольной малатдегидрогеназы ( синтез жирных кислот ),
- глюкозо-6-фосфатдегидрогеназы ( пентозофосфатный путь ),
2. Индукция в адипоцитах синтеза глицеральдегидфосфат-дегидрогеназы и синтазы жирных кислот.
3. Репрессия синтеза мРНК, например, для ФЕП-карбоксикиназы ( глюконеогенез ).
4. Обеспечивает процессы трансляции, повышая фосфорилирование по серину рибосомального белка S6.
Очень медленные эффекты (часы-сутки)
Очень медленные эффекты реализуют митогенез и размножение клеток. Например, к этим эффектам относится
1. Повышение в печени синтеза соматомедина, зависимого от гормона роста.
2. Увеличение роста и пролиферации клеток в синергизме с соматомединами.
3. Переход клетки из G1-фазы в S-фазу клеточного цикла.
Инактивация инсулина
Удаление инсулина из циркуляции происходит после его связывания с рецептором и последующей интернализации (эндоцитоза) гормон-рецепторного комплекса, в основном в печени и мышцах. После поглощения комплекс разрушается и белковые молекулы лизируются до свободных аминокислот. В печени захватывается и разрушается до 50% инсулина при первом прохождении крови, оттекающей от поджелудочной железы. В почках инсулин фильтруется в первичную мочу и, после реабсорбции в проксимальных канальцах, разрушается.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Какой орган и как вырабатывает инсулин, механизм действия
Какой орган вырабатывает инсулин в организме человека
Ответ на вопрос: «Что или какой человеческий орган вырабатывает инсулин» — поджелудочная железа.
Благодаря панкреатическим островкам (Лангерганса), производятся 5 видов гормонов, большинство которых регулируют «сахарные дела» в организме.
- a клетки — вырабатывают глюкагон (стимулирует распад гликогена печени в глюкозу, поддерживая уровень сахара на постоянном уровне)
- b клетки — производят инсулин
- d клетки — синтезирует соматостатин (способен уменьшать выработку инсулина и глюкагона поджелудочной)
- G клетки — продуцируется гастрин (регулирует секрецию сомастотина, и участвует в работе желудка)
- ПП клетки — вырабатывают панкреатический полипептид (стимулирует выработку желудочного сока)
Большую часть клеток составляют бета клетки (b клетки), которые находятся в основном на кончике и в головном отделе железы, и секретируют диабетический гормон инсулин.
Ответ на вопрос: «Что вырабатывает поджелудочная железа кроме инсулина» — гормоны для работы желудка.
Состав инсулина, строение молекулы
Интересно то, что у свиней строение молекулы инсулина практически такое же, отличие есть только в одном остатке — вместо треонина у свинок в цепи В находится аланин. Именно из-за этого сходства свиной инсулин часто используют для изготовления инъекций. Кстати, бычий тоже используют, но он отличается уже на 3 остатка, а значит менее подходит для организма человека.
Выработка инсулина в организме, механизм действия, свойства
Инсулин вырабатывается поджелудочной железой, когда повышается уровень глюкозы в крови.
- Изначально в железе образуется неактивная форма инсулина — препроинсулин . Он состоит из 110 аминокислотных остатков, созданных объединением четырех пептидов — L, B, C и А.
- Далее происходит синтез препроинсулина в эндоплазматическая сеть. Для того, чтобы пройти сквозь мембрану, отщепляется L-пептид, который состоит из 24 остатков. Таким образом возникает проинсулин .
- Проинсулин поступает в комплекс Гольджи, где и продолжит свое созревание. Во время созревание отделяется С-пептид ( состоящий из 31 остатка), который соединял В и А пептиды. В этот момент молекула проинсулина разделяется на две полипептидные цепи, образуя необходимую молекулу инсулина .
Как работает инсулин
Для того, чтобы высвободить инсулин из гранул, в которых он теперь хранится, нужно сообщить поджелудочной о повышении уровня глюкозы в крови. Для этого существует целая цепочка взаимосвязанных процессов, которые активизируются при повышении сахара.
- Глюкоза в клетке подвергается гликолизу и образует аденозинтрифосфат (АТФ).
- АТФ контролирует закрытие ионных калиевых каналов, вызывая деполяризацию мембраны клетки.
- Деполяризация открывает кальциевые каналы, вызывая ощутимый приток кальция в клетку.
- Гранулы, в которых хранится инсулин, реагируют на это повышение, и высвобождают необходимое количество инсулина. Высвобождение происходит с помощью экзоцитоза . То есть гранула сливается с мембраной клетки, цинк, который сковывал активность инсулина, отщепляется, и активный инсулин поступает в организм человека.
Таким образом, организм человека получает необходимый регулятор глюкозы в крови.
За что отвечает инсулин, роль в организме человека
Гормон инсулин участвует во всех обменных процессах в организме человека. Но самая важная его роль — углеводный обмен. Влияние инсулина на углеводный обмен состоит в транспортировке глюкозы непосредственно в клетки организме. Жировые и мышечные ткани, которые составляют две трети тканей человека, являются инсулинозависимыми. Без инсулина глюкоза не может попасть в их клетки. Кроме этого, инсулин также:
- регулирует поглощение аминокислот
- регулирует транспортировку калия, магния и ионов фосфатов
- усиливает синтез жирных кислот
- уменьшает разрушение белков
Очень интересное видео про инсулин ниже.
Ответ на вопрос: «Для чего нужен инсулин в организме» — регулирование углеводного и других обменных процессов в организме.
Заключения
В этой статье я постаралась максимально доступно рассказать какой орган вырабатывает инсулин, процесс выработки и как действует гормон на человеческий организм. Да, пришлось использовать некоторые сложные термины, но без них нельзя было бы максимально полно раскрыть тему. Зато теперь вам видно, какой на самом деле сложный процесс появления инсулина, его работы и влияния на наше здоровье.
Гормоны периферических эндокринных желез — инсулин
Инсулин секретируется β-клетками островков Лангерганса. Инсулин состоит из двух полипептидов — цепи А (21 аминокислота) и цепи В (30 аминокислот), связанных друг с другом двумя дисульфидными мостиками. Гормон продуцируется в виде проинсулина, в котором имеется промежуточный пептид С, соединяющий фрагмент А и В в мономерный полипептид.
Проинсулип частично попадает в периферическую циркуляцию. При окончательном синтезе инсулина в поджелудочной железе фрагмент С отщепляется. Существуют некоторые видовые различия в аминокислотном составе инсулина, причем в настоящее время получен синтетический инсулин. Молекулы инсулина в крови имеют тенденцию к агрегации. Молекулярный вес инсулина в кислой среде равен 12 000 и в щелочной — 6000.
Синтез и секреция инсулина регулируются различным образом. Секреция инсулина стимулируется глюкозой, фруктозой, рибозой, аминокислотами, кетоновыми телами, глюкагоном, соматотропниом, АКТГ, плацентарным лактогеном, глюкокортикоидами, тироксином, эстрогенами, секретином, панкреозимином, гастрином, циклическим АМФ, калием, при стимуляции вагуса и рядом фармакологических препаратов.
Уменьшение секреции инсулина происходит под влиянием голодания, катехоламинов, инсулина, а также ряда препаратов (2-дезоксиглюкоза, бигуанидиновые антидиабетические препараты, дифенин). Панкреатический инсулин находится в крови в свободной и связанной форме. Свободный инсулин иногда обозначают так же, как иммунологически реактивный инсулин, так как он может быть определен методами с использованием иммуносыворотки к инсулину.
Свободный инсулин действует как на мышечную, так и на жировую ткань. Концентрация этого инсулина составляет в норме в базальном состоянии 5-14 мкед/мл, но значительно возрастает после стандартной глюкозной нагрузки.
Значительная часть инсулиновой активности крови определяется инсулином, связанным с белком (связанный инсулин). В этой форме инсулин не действует на мышечную ткань и, как видно, тормозит даже действие на нее свободного инсулина. Однако в жировой ткани имеется фактор, освобождающий свободный инсулин из комплекса, благодаря чему осуществляется действие гормона.
Кроме неподавляемого иммуносывороткой связанного инсулина, некоторые исследователи обнаруживают инсулиноподобную активность, которая также не тормозится иммуносывороткой, однако по ряду свойств отличается от связанного инсулина. Эта форма иногда обозначается как атипичный инсулин.
Некоторые исследователи считают, что атипичный и связанный инсулин — идентичные формы; другие на основании того, что уровень атипичного инсулина (в отличие от связанного) не увеличен при диабете, отвергают их идентичность.
Имеются данные, что неподавляемый инсулин представляет собой полипептид с молекулярным весом около 8000 и не содержит в своей структуре цепей инсулина А и В. Таким образом, суммарная инсулиноподобная активность сыворотки включает в себя свободный инсулин, а также другие факторы с инсулиновой активностью, среди которых различаются связанный и атипичный инсулин и некоторые другие биологические вещества с инсулиноподобным действием (соматомедин). Кроме того, в крови циркулирует проинсулин, а также С-пептид, соединяющий в молекуле проинсулина цепь А и В.
Физиологическое действие инсулина, как принято в настоящее время считать, в значительной степени связано с регуляцией транспорта глюкозы и аминокислот через клеточную мембрану скелетных мышц, сердечной мышцы, жировой ткани, лимфоцитов и фибробластов. Как видно, транспорт сахара в печень не регулируется инсулином. Однако инсулин влияет на поглощение и выделение сахара печенью, стимулирует синтез в печени глюкокиназы, повышает включение аминокислот в белки печени и т. д.
После поступления глюкозы в клетку происходит ее фосфорилирование при шестом атоме углерода (С-6) с образованием глюкозо-6-фосфата, что осуществляется АТФ в присутствии гексокиназы и Mg++. Дальнейший метаболизм глюкозо-6-фосфата происходит различными путями, из которых основными являются следующие: гликолиз, пентозный цикл, цикл глюкуроновой кислоты, гликогенез.
Инсулин, контролируя начальные этапы утилизации глюкозы, оказывает очень важное влияние на основные пути обмена веществ в организме. В этом отношении необходимо подчеркнуть значение анаболического эффекта инсулина, а также его способность стимулировать развитие молочной железы.
Открытие рецепторов инсулина в тимоцитах показывает, что инсулин может быть одним из факторов, от которых зависит активность иммунологической защиты. Таким образом, инсулин, наряду с гормоном роста, является гормоном очень широкого спектра действия. Его влияние широко простирается и в направлении формирования специфических патологических процессов.
Вторым важнейшим свойством инсулина является его антилиполитическое действие, т. е. способность тормозить липолиз. Это влияние осуществляется через торможение действия цАМФ. Антилиполитическое действие инсулина проявляется при дозах, меньших, чем гипогликемическое.
При йодировании инсулина может быть устранено влияние на утилизацию глюкозы (гипогликемический эффект), но сохранено антилиполитическое влияние. Применение этого препарата в эксперименте показало, что при торможении липолиза повышается чувствительность к действию инсулина и толерантность к углеводам. Инактивация инсулина в тканях осуществляется главным образом инсулиназой.