Физические свойства сахарозы
65. Сахароза, ее физические и химические свойства
Физические свойства и нахождение в природе.
1. Она представляет собой бесцветные кристаллы сладкого вкуса, хорошо растворима в воде.
2. Температура плавления сахарозы 160 °C.
3. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
4. Содержится во многих растениях: в соке березы, клена, в моркови, дыне, а также в сахарной свекле и сахарном тростнике.
Строение и химические свойства.
1. Молекулярная формула сахарозы – С12Н22О11.
2. Сахароза имеет более сложное строение, чем глюкоза.
3. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди.
4. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала», при нагревании с гидроксидом меди (II) не образует красного оксида меди (I).
5. Сахароза, в отличие от глюкозы, не является альдегидом.
6. Сахароза является важнейшим из дисахаридов.
7. Она получается из сахарной свеклы (в ней содержится до 28 % сахарозы от сухого вещества) или из сахарного тростника.
Реакция сахарозы с водой.
Если прокипятить раствор сахарозы с несколькими каплями соляной или серной кислоты и нейтрализовать кислоту щелочью, а после этого нагреть раствор с гидроксидом меди (II), выпадает красный осадок.
При кипячении раствора сахарозы появляются молекулы с альдегидными группами, которые и восстанавливают гидроксид меди (II) до оксида меди (I). Эта реакция показывает, что сахароза при каталитическом действии кислоты подвергается гидролизу, в результате чего образуются глюкоза и фруктоза:
6. Молекула сахарозы состоит из соединенных друг с другом остатков глюкозы и фруктозы.
Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, можно выделить мальтозу и лактозу.
1) мальтоза получается из крахмала под действием солода;
2) она называется еще солодовым сахаром;
3) при гидролизе она образует глюкозу:
Особенности лактозы: 1) лактоза (молочный сахар) содержится в молоке; 2) она обладает высокой питательностью; 3) при гидролизе лактоза разлагается на глюкозу и галактозу – изомер глюкозы и фруктозы, что является важной особенностью.
66. Крахмал и его строение
Физические свойства и нахождение в природе.
1. Крахмал представляет собой белый порошок, не растворимый в воде.
2. В горячей воде он набухает и образует коллоидный раствор – клейстер.
3. Являясь продуктом усвоения оксида углерода (IV) зелеными (содержащими хлорофилл) клетками растений, крахмал распространен в растительном мире.
4. Клубни картофеля содержат около 20 % крахмала, зерна пшеницы и кукурузы – около 70 %, риса – около 80 %.
5. Крахмал – одно из важнейших питательных веществ для человека.
2. Образуется он в результате фотосинтетической деятельности растений при поглощении энергии солнечного излучения.
3. Сначала из углекислого газа и воды в результате ряда процессов синтезируется глюкоза, что в общем виде может быть выражено уравнением: 6СO2 + 6Н2О = С6Н12O6 + 6O2.
5. Макромолекулы крахмала неодинаковы по размерам: а) в них входит разное число звеньев С6H10O5 – от нескольких сотен до нескольких тысяч, при этом неодинакова и их молекулярная масса; б) различаются они и по строению: наряду с линейными молекулами с молекулярной массой в несколько сотен тысяч имеются молекулы разветвленного строения, молекулярная масса которых достигает нескольких миллионов.
Химические свойства крахмала.
1. Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба и нагреть крахмальный клейстер с гидроксидом меди (II), будет видно образование оксида меди (I).
2. Если прокипятить крахмальный клейстер с небольшим количеством серной кислоты, нейтрализовать раствор и провести реакцию с гидроксидом меди (II), образуется характерный осадок оксида меди (I). То есть при нагревании с водой в присутствии кислоты крахмал подвергается гидролизу, при этом образуется вещество, восстанавливающее гидроксид меди (II) в оксид меди (I).
3. Процесс расщепления макромолекул крахмала водой идет постепенно. Сначала образуются промежуточные продукты с меньшей молекулярной массой, чем у крахмала, – декстрины, затем изомер сахарозы – мальтоза, конечным продуктом гидролиза является глюкоза.
4. Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К. Кирхгоф. Разработанный им способ получения глюкозы используется и в настоящее время.
5. Макромолекулы крахмала состоят из остатков молекул циклической L-глюкозы.
Физические свойства сахарозы
Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
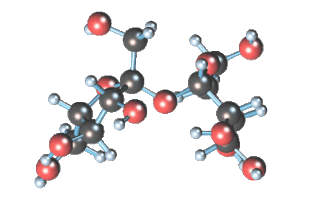
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11 .
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
Для сахарозы характерны реакции по гидроксильным группам.
1. Качественная реакция с гидроксидом меди (II)
Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):
2. Реакция окисления
Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
Реакция «серебряного зеркала»
Реакция с гидроксидом меди (II)
Невосстанавливающий дисахарид
Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
3. Реакция гидролиза
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Видеоопыт «Кислотный гидролиз сахарозы»
Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
В живых организмах гидролиз дисахаридов происходит при участии ферментов.
Получение сахарозы
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.). чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок. Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.
Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).
Сахароза, свойства, получение и применение
Сахароза, свойства, получение и применение.
Сахароза – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы, имеющий формулу C12H22O11.
Сахароза, формула, молекула, строение, вещество:
Сахароза – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы, имеющий формулу C12H22O11.
В быту сахароза именуется сахаром, тростниковым сахаром или свекловичным сахаром.
Олигосахариды – это углеводы, содержащие от 2 до 10 моносахаридных остатков. Дисахариды – углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Сахароза является весьма распространённым в природе дисахаридом и углеводом . Она встречается во многих фруктах, плодах, ягодах, в стеблях и листьях растений , в соке деревьев . Особенно велико содержание сахарозы в сахарной свёкле, сахарном тростнике, сорго, сахарном клене, кокосовой пальме, финиковой пальме, аренге и иных пальмах, которые используются для промышленного производства пищевого сахара.
Химическая формула сахарозы C12H22O11.
Аналогичную общую химическую формулу имеют и другие дисахариды: лактоза, состоящая из остатков глюкозы и галактозы, и мальтоза, состоящая из остатков глюкозы.
Строение молекулы сахарозы, структурная формула сахарозы:
Молекула сахарозы образована из двух остатков моносахаридов – α-глюкозы и β-фруктозы, соединённых между собой атомом кислорода и связанных друг с другом за счёт взаимодействия гидроксильных групп (двух полуацетальных гидроксилов) – (1→2)-гликозидной связью.
Систематическое химическое наименование сахарозы: (2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-дигидрокси-2,5-бис(гидроксиметил)оксолан-2-ил]окси-6-(гидроксиметил)оксан-3,4,5-триол.
Используется также и другое химическое название сахарозы: α-D-глюкопиранозил-β-D-фруктофуранозид.
По внешнему виду сахароза представляет собой белое кристаллическое вещество . На вкус более сладкая, чем глюкоза.
Сахароза очень хорошо растворяется в воде. Малорастворима в этаноле и метаноле. Не растворима в диэтиловом эфире .
Сахароза, попадая в кишечник, под действием ферментов быстро гидролизуется на глюкозу и фруктозу, после чего всасывается и попадает в кровь.
Температура плавления сахарозы 160 °C. Расплавленная сахароза застывает, образуя аморфную прозрачную массу – карамель.
Если расплавленную сахарозу продолжить нагревать, то при температуре 186 °C сахароза разлагается с изменением окраски – с прозрачной на коричневую.
Сахароза служит источником глюкозы и важнейшим источником углеводов для организма человека.
Физические свойства сахарозы:
| Наименование параметра: | Значение: |
| Цвет | белый, бесцветный |
| Запах | без запаха |
| Вкус | сладкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое кристаллическое вещество |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), г/см 3 | 1,587 |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1587 |
| Температура разложения, °C | 186 |
| Температура плавления, °C | 160 |
| Температура кипения, °C | — |
| Молярная масса сахарозы, г/моль | 342,2965 ± 0,0144 |
Химические свойства сахарозы. Химические реакции (уравнения) сахарозы:
Основные химические реакции сахарозы следующие:
- 1. реакция сахарозы с водой (гидролиз сахарозы):
При гидролизе (при нагревании в присутствии ионов водорода ) сахароза расщепляется на составляющие ее моносахариды за счёт разрыва гликозидных связей между ними. Данная реакция является обратной процессу образования сахарозы из моносахаридов.
Аналогичная реакция происходит в кишечнике у живых организмов при попадании в него сахарозы. В кишечнике сахароза под действием ферментов быстро гидролизуется на глюкозу и фруктозу.
- 2. качественная реакция на сахарозу (реакция сахарозы с гидроксидом меди):
В молекуле сахарозы имеется несколько гидроксильных групп. Для подтверждения их наличия используют реакцию с гидроксидами металлов , например, с гидроксидом меди .
Для этого к раствору сахарозы добавляют гидроксид меди . В результате образуется сахарат меди , а раствор окрашивается в ярко-синий цвет.
- 3. не дает реакцию «серебряного зеркала»:
Альдегидной группы в сахарозе нет. Поэтому она при нагревании с аммиачным раствором оксида серебра не дает реакцию «серебряного зеркала», т.к. сахароза не способна превращаться в открытую форму, содержащую альдегидную группу.
Кроме того, при нагревании с гидроксидом меди (II) сахароза не образует красного оксида меди (I).
Реакция «серебряного зеркала» и реакция с гидроксидом меди (II) с образованием красного оксида меди (I) характерны для лактозы и мальтозы.
Поэтому сахарозу еще именуют невосстанавливающим дисахаридом, т.к. она не восстанавливает Ag2O и Cu(OH)2.
Получение и производство сахарозы:
Сахароза содержится во многих фруктах, плодах, ягодах, в стеблях и листьях растений , в соке деревьев . Поэтому получение сахарозы связано с выделением ее из ее источников: сахарного тростника, сахарной свеклы и пр.
Получение сахарозы из сахарного тростника:
Сахарный тростник является основной мировой культурой для производства сахара. На его долю приходится до 65 % мирового производства сахара.
Сахарный тростник до начала цветения срезают. Срезанные стебли измельчают и размалывают. Из полученной массы отжимают сок, в котором содержится до 0,03 % белковых веществ, 0,1 % зернистых веществ (крахмала), 0,22 % азотосодержащей слизи, 0,29 % солей (большей частью органических кислот), 18,36 % сахара, 81 % воды и очень небольшое количество ароматических веществ, придающих сырому соку своеобразный запах.
Для очистки сока к нему добавляют свежегашеную известь – Са(ОН)2 и нагревают. Сахароза вступает в химическую реакцию с гидроксидом кальция, в результате чего образуется растворимый в воде сахарат кальция . Кроме того, другие вещества, содержащиеся в соке, также вступают в реакцию с гидроксидом кальция, образуя малорастворимые и нерастворимые соли, которые выпадают в осадок и отфильтровывают.
Затем через раствор, чтобы разложить сахарат кальция и нейтрализовать избыточный гидроксид кальция, пропускают углекислый газ – СО2. В итоге образуется карбонат кальция – СаСО3, который выпадает в осадок. Выпавший в осадок карбонат кальция отфильтровывают, а раствор выпаривают в вакуумных аппаратах до получения кристаллов сахарозы. На данной стадии производства сахароза все еще содержит примеси – мелассу и имеет коричневый цвет. Меласса придает сахарозе ярко выраженный естественный аромат и вкус. Полученный продукт именуется коричневым сахаром или тростниковым нерафинированным сахаром. Он (коричневый сахар) пригоден в пищу. Его можно использовать в пищу как есть либо подвергнуть дополнительной очистке .
На последней стадии производства сахарозу подвергают дополнительной очистке и обесцвечиванию. В конечном итоге получают рафинированный (очищенный) сахар, имеющий белый цвет.
Получение сахарозы из сахарной свеклы:
Сахарная свекла является двухлетним растением. В первый год собирают урожай корнеплодов и отправляют их на переработку.
На перерабатывающей фабрике корнеплоды промываются и измельчаются. Измельченные корнеплоды помещают в диффузоры (большие котлы) с горячей водой температурой 75 о С. Горячая вода вымывает из измельченных корнеплодов сахарозу и прочие компоненты. В итоге получается диффузионный сок, который в дальнейшем подвергается фильтрации от содержащихся в нем частичек мякоти.
На следующих стадиях производства сахара диффузионный сок очищают гидроксидом кальция и углекислым газом, уваривают, выпаривают на вакуумных аппаратах , подвергают дополнительной очистке , отбеливанию и центрифугированию. В итоге получают рафинированный сахар.
Получение сахарозы из сахарного клена:
Сахарозу из сахарного клена получают в восточных провинциях Канады.
В феврале-марте ствол сахарного клена просверливают. Из отверстий вытекает кленовый сок, который собирают . Он содержит до 3 % сахарозы.
Кленовый сок выпаривают, получая «кленовый сироп». Далее «кленовый сироп» очищают гидроксидом кальция и углекислым газом, выпаривают на вакуумных аппаратах, подвергают дополнительной очистке и отбеливанию, тем самым получая готовый продукт – сахар.
Применение сахарозы:
– в качестве продукта питания, а также для приготовления различных продуктов питания (кондитерских изделий, напитков, соусов и пр.)
– в кондитерской промышленности как консервант,
– используется для приготовления искусственного меда,
– в химической промышленности для производства этанола, бутанола, глицерина, лимонной кислоты, декстрана и пр.,
– в фармацевтической промышленности для изготовления различных лекарственных средств.
Сахароза (Энциклопедия)
Для нормального питания взрослого мужчины, не обремененного большой физической работой, требуется принимать в сутки объем пищи, питательная энергетическая ценность (калорийность) которой составляет примерно 3000 ккал. Этому соответствует прием следующего количества основных питательных веществ (в чистом виде): 100 г белков (калорийность 1 г – 4,8 ккал, или 20,1 кДж), 100 г жиров (калорийность 9,3 ккал/г) и 400 г углеводов (калорийность 4 ккал/г).
По калорийности углеводы уступают белкам и жирам, но в суточном рационе человека суммарная калорийность углеводов составляет более половины, а по объему пищи – около двух третей. Именно углеводы являются основным источником энергии для организма человека.
Главный углевод в питании человека – нерастворимый в воде полисахарид крахмал (в хлебном зерне, картофеле и т.п.) – для усвоения в организме должен быть прежде всего разложен на моносахариды и переведен в раствор (это производится ферментами слюны и желудочного сока), на что требуется время. Растворимый же углевод – дисахарид сахароза, или обычный сахар, разлагается на моносахариды (глюкозу и фруктозу) и усваивается значительно быстрее крахмала, поэтому человек так охотно заменяет в своем питании часть крахмала сахаром, имеющим, кроме того, сладкий вкус. Для быстрого восстановления затраченной энергии (при походах, спорте, большой физической работе, для больных и выздоравливающих) сахар как питательное вещество особенно ценен по быстроте и легкости его усваивания.
Благодаря ценным пищевым, вкусовым и физическим свойствам сахароза (сахар) сделалась важнейшим пищевым продуктом первой необходимости.
Быстрая усвояемость сахарозы, однако, не позволяет пользоваться ею как единственным пищевым углеводом. Сравнительно медленно переваривающийся крахмал равномерно снабжает кровь глюкозой. Потребление же сахарозы в значительных дозах перегружает кровь глюкозой, которая в этом случае начинает перерабатываться в жиры, т.е. начинается ожирение организма. Поэтому определено, что лишь до 20 % требуемого количества углеводов может быть потреблена в виде сахара. Таким образом, в сутки допустимо потреблять примерно 80 г сахара во всех его видах (в натуре, в кондитерских изделиях, в напитках и т.п.), что составляет около 30 кг сахара в год.
Обычный сахар, который мы покупаем в магазине, более чем на 99,7 % состоит из сахарозы.
К этому классу относятся более или менее сладкие на вкус сахара как моносахариды (например, глюкоза и фруктоза), так и олигосахариды (например, сахароза и раффиноза), а также полисахариды (например, целлюлоза и крахмал).
| Рисунок 1 Форма кристалла сахарозы |
Молекулярная масса сахарозы – 342,296. Молекула сахарозы содержит 42,11% углерода, 6,43 % водорода и 51,46 % кислорода.
Сахароза является кристаллическим веществом, молекулярное строение которого имеет закономерную для него специальную решетку.
Нормальный, выращенный в чистом растворе кристалл сахарозы имеет сложную многогранную (15 и более граней) форму.
| Рисунок 2 Различные формы кристаллов сахара |
Известны 15 видов кристаллов сахарозы, часто наблюдаются двойниковые кристаллы, форма кристаллов зависит от условий процесса кристаллизации, примесей в исходном растворе и степени пересыщения сахарозой этого раствора.
Плотность кристаллов сахарозы без включений при 20 о С – 1,5915 г/см 3 , удельный объем – 0,628 см 3 /г .
Кристаллы размером 1,5-2,5 мм относятся к крупной фракции, размером 0,5-1,5 мм – к средней, размером до 0,5 мм – к мелкой.
В 1 г содержится примерно следующее количество кристаллов сахарозы:
| крупная фракция | 1,5 тыс. шт. |
| средняя фракция | 3 тыс. шт. |
| мелкая фракция | 5 тыс. шт. |
Чистые кристаллы сахарозы прозрачны и бесцветны. При раздавливании кристаллы сахарозы дают очень яркие вспышки кристаллолюминисценции. Кристалл сахарозы – изолятор. Объемное термическое расширение сахарозы составляет 0,00011 % на 1°С .
Чистые растворы сахарозы не электропроводны и химически нейтральны, т.е. их рН=7.
В водных растворах сахароза под влиянием кислот, присоединяя воду, расщепляется (процесс инверсии) на свои составные части – глюкозу и фруктозу.
Под действием некоторых ферментов, дрожжей, плесени и бактерий сахароза также разлагается на глюкозу и фруктозу.
Растворимость сахарозы в чистой воде значительна и быстро растет с повышением температуры. В этиловом и метиловом спиртах сахароза практически не растворяется.
Сахароза плавится при температуре 186-188°С, происходит т.н. “кара-мелизация” сахарозы, или образование сложных, окрашенных в бурый цвет горького вкуса веществ.
Химически чистую сахарозу для научных исследований готовят, растворяя в дистиллированной воде лучший рафинированный товарный сахар с последующим осаждением безводным этиловым спиртом, причем этот процесс повторяют несколько раз.
Сахароза: применение и химические свойства
Что представляет собой сахароза
Сахароза – дисахарид, органическое соединение, образованное остатками двух моносахаридов: глюкозы и фруктозы. В чистом виде сахароза представляет собой белый порошок, обладающий сладким вкусом, с температурой плавления 185 градусов. Добавим, что так называют быстрый углевод, который разлагается в пищеварительном тракте.
Организм млекопитающих, в том числе человека, не умеет усваивать сахарозу в чистом виде. Поэтому сначала происходит ее гидролиз – химическая реакция взаимодействия вещества с водой, в ходе которой при помощи фермента сахаразы образуются глюкоза и фруктоза. Начинается этот процесс в ротовой полости – при помощи слюны, а завершается в тонком кишечнике. Полученные в ходе этой реакции вещества могут легко всасываться в кровь.
В этой связи нужно упомянуть такое понятие как гликемический индекс, обозначающее скорость усвоения углеводов. Чем он выше, тем быстрее повышается уровень глюкозы в крови, поджелудочная железа быстрее выбрасывает инсулин, а клетки получают энергию. Как правило, при этом за 100 % берется глюкоза. Оказывается, что гликемический индекс сахарозы составляет всего 58%.
Что говорят диетологи о сахаре
Современные диетологи о сахаре далеко не лучшего мнения, считают его вредным для организма. Наиболее рьяные противники именуют этот привычный продукт «белой смертью». Почему же так происходит? Дело в том, за последние 20-30 лет количество полных людей в западных странах резко возросло. Если в 70-е годы американские врачи утверждали, что основная причина «эпидемии полноты» – продукты, содержащие животные жиры, то сейчас ситуация изменилась. Многочисленные эксперименты подтверждают, что сахароза более опасна.
Несколько лет назад в научном журнале «Nature» вышла статья с громким названием «Ядовитая правда о сахаре». Одним из авторов этой публикации является американский профессор Роберт Ластиг. Ученый уверяет, что в массовом ожирении жителей США виновен именно сахар, прежде всего тот, который содержится в продуктах питания.
Оказывается, мы употребляем много сахара в скрытом виде, который добавляют для улучшения вкуса в мясные, молочные и хлебобулочные продукты, консервы. Кроме того простые углеводы обильно включают сегодня в популярные продукты, которые принято считать «здоровыми»: йогурты и хлопья. Сладкий вкус стимулирует употребление пищи, даже когда мы не испытываем голода.
Еще один противник употребления сахарозы — техасский кардиолог Генрих Такмайер. Он считает, что из-за увеличения в нашем рационе количества сладостей стало гораздо больше пациентов с сердечно-сосудистыми расстройствами. Проведя ряд экспериментов, он обнаружил вещество – глюкозо-6-фосфат, которое угнетает работу миокарда.
Как же быть, если очень хочется сладкого? Диетологи рекомендуют использовать заменители сахара: стевиозид, сорбит, ксилит. А вот аспартам лучше не покупать, поскольку доказано, что распадаясь, он образует в организме токсины.
Также сладкоежкам рекомендуется вводить в рацион продукты, которые содержат сахарозу: бананы, персики, абрикосы, слива. Также можно использовать продукты, богатые глюкозой и сладкие на вкус: мед, финики, изюм, курагу.
Сахар в спорте:средство для выносливости
Несмотря на то, что сахар снискал недобрую славу, можно утверждать, что для спортсменов этот продукт полезен. Недавно в ведущем международном журнале «American Journal of Physiology – Endocrinology
В эксперименте приняло участие несколько атлетов, участвующих в гонках на длинные дистанции. В итоге выяснилось, что применение сахара в спорте помогает бороться с усталостью. Они уверяют, что так можно оптимальным образом восстановить уровень гликогена. Кроме того, напиток, содержащий одну глюкозу, вызывает дискомфорт в кишечнике, поэтому лучше использовать смесь быстрых углеводов.
Если говорить о других сильных средствах для выносливости атлетов можно назвать пищевую добавку «Леветон Форте», содержащую все вещества, необходимые при активных тренировках: аминокислоты, витамины, микроэлементы. Входящий в состав препарата трутневый расплод включает простые углеводы: сахарозу, глюкозу, фруктозу.
Рассмотрев свойства и области применения вещества, можно сказать, что сахароза остается важным продуктом для пищевой промышленности, фармацевтики и спорта. Но чтобы избежать опасных заболеваний, необходимо соблюдать суточную норму его потребления.
Сферы применения
Если говорить о применении сахара в производстве, нужно выделить три основные сферы. Во-первых, назовем пищевую промышленность – сахар до сих пор остается непременным атрибутом обеденного стола большинства людей. Наряду с этим сахарозу используют в качестве консерванта, добавляя в некоторые алкогольные напитки, соусы.
Во-вторых, этот простой углевод применяют в химической промышленности как субстрат для производства бутанола, этанола, глицерина и других веществ.
Еще одна важная область применения сахарозы – фармацевтика, где ее используют для приготовления различных сиропов и микстур. Также она необходима для выпуска многих препаратов, поскольку является хорошим консервантом.
Сахароза – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы, имеющий формулу C12H22O11.
Сахароза, формула, молекула, строение, вещество
Физические свойства сахарозы
Химические свойства сахарозы. Химические реакции (уравнения) сахарозы
Получение и производство сахарозы:из сахарного тростника,сахарной свеклы и сахарного клена
– в качестве продукта питания, а также для приготовления различных продуктов питания (кондитерских изделий, напитков, соусов и пр.)
– в кондитерской промышленности как консервант,
– используется для приготовления искусственного меда,
– в химической промышленности для производства этанола, бутанола, глицерина, лимонной кислоты, декстрана и пр.,
– в фармацевтической промышленности для изготовления различных лекарственных средств.
Поскольку у сахарозы немало ценных особенностей, ее широко применяют.
Основными сферами ее использования можно назвать:
- Пищевую промышленность. В ней этот компонент используется в виде самостоятельного продукта и в качестве одного из компонентов, входящих в состав кулинарных изделий. Его используют для изготовления сладостей, напитков (сладких и алкогольных), соусов. Также из этого соединения изготавливают искусственный мед.
- Биохимию. В этой сфере углевод является субстратом для ферментации некоторых веществ. Среди них находятся: этанол, глицерин, бутанол, декстран, лимонная кислота.
- Фармацевтика. Это вещество часто включают в состав лекарственных средств. Оно содержится в оболочках таблеток, сиропах, микстурах, лечебных порошках. Такие препараты обычно предназначены для детей.
Также продукт находит применение в косметологии, сельском хозяйстве, при производстве бытовой химии.
Широкое применение сахарозы обусловлено ее способностью к подслащению и свойствами функциональной консистенции. По этой причине она важна для структуры некоторых продуктов питания, особенно кондитерских изделий.
Также является вспомогательным компонентом в сохранении пищи, будучи добавкой, широко используемой в приготовлении так называемой нездоровой пищи.
В проросших семенах растений жиры и белки, находящиеся на хранении, превращаются в сахарозу для транспортировки в процессе развития растений.
Главная функция сахарозы в организме человека — она помогает вырабатывать энергию, необходимую для функционирования различных органов.
- Пищевая индустрия. Дисахарид используют как самостоятельный продукт питания (сахар), консервант (в высоких концентрациях), составной компонент кулинарных изделий, алкогольных напитков, соусов. Кроме того, из сахарозы получают искусственный мёд.
- Биохимия. Полисахарид применяют как субстрат при получении (ферментации) глицерина, этанола, бутанола, декстрана, левулиновой и лимонной кислот.
- Фармакология. Сахарозу (из сахарного тростника) используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).
Помимо этого, сахарозу в сочетании жирными кислотами, применяют как неионные детергенты (вещества, улучшающие растворимость в водных средах) в сельском хозяйстве, косметологии, при создании моющих средств.