Синтез Болезниа биохимия
БИОСИНТЕЗ НАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
В настоящее время в достаточной степени изучен механизм биосинтеза жирных кислот в организме животных и человека, а также катализирующие этот процесс ферментные системы. Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот. Установлено, что в цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из уже синтезированной в цитоплазме клетки пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома.
Иными словами, митохондриальная система биосинтеза жирных кислот, включающая несколько модифицированную последовательность реакций β-окисления, осуществляет только удлинение существующих в организме среднецепочечных жирных кислот, в то время как полный биосинтез пальмитиновой кислоты из ацетил-КоА активно протекает в цитозоле, т.е. вне митохондрий, по совершенно другому пути.
Внемитохондриальная система биосинтеза de novo жирных кислот (ли-погенез). Эта система находится в растворимой (цитозольной) фракции клеток многих органов, в частности печени, почек, мозга, легких, молочной железы, а также в жировой ткани. Биосинтез жирных кислот протекает с участием НАДФН, АТФ, Мn 2+ и НСО3 – (в качестве источника СО2); субстратом является ацетил-КоА, конечным продуктом – пальмитиновая кислота. Потребности в кофакторах процессов биосинтеза и β-окисления жирных кислот значительно различаются.
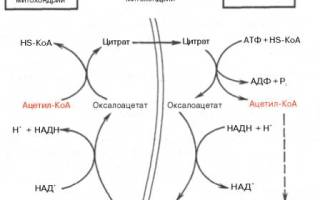
Как отмечалось, строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который в основном поступает из митохондрий. Было выявлено, что цитрат стимулирует синтез жирных кислот в цитозоле клетки. Известно также, что образующийся в митохондриях в процессе окислительного декарбоксилирования пирувата и окисления жирных кислот ацетил-КоА не может диффундировать в цитозоль клетки, так как митохондриальная мембрана непроницаема для данного субстрата. Поэтому вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы.
В цитозоле цитрат реагирует с HS-KoA и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитратлиазой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидрогеназы восстанавливается до малата. Последний при помощи дикарбокси-латтранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цикл:
Существует еще один путь переноса внутримитохондриального аце-тил-КоА в цитозоль клетки – с участием карнитина. Как отмечалось, кар-нитин играет роль переносчика ацильных групп из цитозоля в митохондрии при окислении жирных кислот. По-видимому, он может выполнять эту роль и в обратном процессе, т.е. в переносе ацильных радикалов, в том числе ацетильного радикала, из митохондрий в цитозоль клетки. Однако, когда речь идет о синтезе жирных кислот, данный путь переноса ацетил-КоА не является главным.
Образование малонил-КоА. Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-карбоксилаза. Фермент содержит в качестве простетической группы биотин. Авидин – ингибитор биотина угнетает эту реакцию, как и синтез жирных кислот в целом.
Установлено, что ацетил-КоА-карбоксилаза состоит из переменного числа одинаковых субъединиц, каждая из которых содержит биотин, биотинкарбоксилазу, карбоксибиотинпереносящий белок, транскарбоксилазу, а также регуляторный ал-лостерический центр, т.е. представляет собой полиферментный комплекс.
Реакция протекает в два этапа: I – карбоксилирование биотина с участием АТФ и II – перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА:
Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты.
Энзиматические системы, осуществляющие синтез жирных кислот, называются жирно-кислотными синтетазами. Они широко встречаются в природе и могут быть изолированы из различных одноклеточных организмов, растений и животных тканей.
Жирно-кислотные синтетазы делятся на 2 группы. К первой группе относятся полиэнзимные, не поддающиеся фракционированию комплексы с мол. м. порядка 500000, в которых все индивидуальные энзимы собраны в компактную структуру. В частности, в эту группу входят жирно-кислотные синтетазы животных тканей и дрожжей.
Вторая группа включает жирно-кислотные синтетазы, из которых отдельные энзимы могут быть выделены методами белкового фракционирования. Такие синтетазы встречаются у ряда микроорганизмов (в частности, у E.coli) и растений. Иными словами, в этих случаях все индивидуальные ферменты синтетазной системы находятся в виде автономных полипептидов.
Мультиферментный комплекс, называемый синтетазой (синтазой) жирных кислот, состоит из 6 ферментов, связанных с так называемым ацилпереносящим белком (АПБ). Этот белок относительно термостабилен, имеет две свободные HS-группы (цистеина и фосфопантетеинового остатка, присоединенного к ОН-группе серина) и вовлекается в процесс синтеза высших жирных кислот практически на всех его этапах. Мол. масса АПБ составляет около 10000. Данный белок в синтетазной системе выполняет роль КоА. Заметим, что в животных тканях не удалось обнаружить свободного АПБ, подобного микробному. Из печени выделен полиэнзимный комплекс, содержащий все энзимы, необходимые для синтеза жирных кислот. Энзимы комплекса настолько прочно связаны друг с другом, что все попытки изолировать их в индивидуальном виде не увенчались успехом. Приводим последовательность реакций, происходящих при синтезе жирных кислот:
Далее цикл реакций повторяется. Допустим, что идет синтез пальмитиновой кислоты (С16). В этом случае образованием бутирил-АПБ завершается лишь первый из 7 циклов, в каждом из которых началом является присоединение молекулы малонил-АПБ к карбоксильному концу растущей цепи жирной кислоты. При этом отщепляется дистальная карбоксильная группа малонил-АПБ в виде СО2. Например, образовавшийся в первом цикле бутирил-АПБ взаимодействует с малонил-АПБ:
Завершается синтез жирной кислоты отщеплением HS-АПБ от ацил-АПБ под влиянием фермента деацилазы. Например:
Суммарное уравнение синтеза пальмитиновой кислоты можно записать так:
Или, учитывая, что на образование одной молекулы малонил-КоА из ацетил-КоА расходуются одна молекула АТФ и одна молекула СО2, которая затем отщепляется, суммарное уравнение можно представить в следующем виде:
Основные этапы биосинтеза жирных кислот можно представить в виде схемы:
В общем виде синтез жирных кислот у кишечной палочки представлен на рис. 11.4. Последовательность и характер реакций в синтезе жирных кислот, начиная с образования β-кетоацил-АПБ (на рис. 11.4 – ацетоацетил-АПБ) и кончая завершением одного цикла удлинения цепи на два углеродных атома, являются как бы обратными реакциями окисления жирных кислот. На самом деле пути синтеза и окисления жирных кислот не пересекаются даже частично. Это становится очевидным, если принять во внимание некоторые особенности синтеза и окисления жирных кислот.
Рис. 11.4. Синтез пальмитиновой кислоты у кишечной палочки при участии одной молекулы ацетил-КоА и 7 молекул малонил-КоА. Подробно представлен первый цикл синтеза – образование бутирил-АПБ. Остальные 6 циклов аналогичны первому.
По сравнению с β-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); при биосинтезе образуется D(–)-изомер 3-гидроксикис-лоты, а не L(+)-изомер, как это имеет место при β-окислении жирных кислот; необходимость для синтеза жирных кислот кофермента НАДФН. Последний в организме частично (на 50%) образуется в реакциях пен-тозофосфатного цикла, частично – в других реакциях, в частности в реакциях:
Малат + НАДФ + -> Пируват + С02 + НАДФН + Н + Изоцитрат + НАДФ + -> α-Кетоглутарат + С02 + НАДФН + Н + .
Образование ненасыщенных жирных кислот. Элонгация жирных кислот. В отличие от растительных тканей ткани животных обладают весьма ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные.
Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот.
Эти превращения протекают в микросомах клеток печени и жировой ткани при участии молекулярного кислорода, восстановленной системы пиридиновых нуклеотидов и цитохрома b5. Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название деса-тураз.
Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Энзиматическая система, катализирующая удлинение жирных кислот, получила название элонгазы. На схеме представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации.
Накопление мочевой кислоты бьет по суставам и почкам
Самым частым нарушением обмена пуринов является повышенное образование мочевой кислоты с развитием гиперурикемии. Особенностью является то, что растворимость солей мочевой кислоты (уратов) в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой.
В зависимости от длительности и тяжести гиперурикемия проявляется:
- Появление тофусов (греч. tophus – пористый камень, туф) – отложение уратных кристаллов в коже и подкожных слоях, в мелких суставах ног и рук, в сухожилиях, хрящах, костях и мышцах.
- Нефропатии в результате кристаллизации мочевой кислоты с поражением почечных канальцев и мочекаменная болезнь .
- Подагра – поражение мелких суставов.
Для диагностики нарушений используют определение концентрации мочевой кислоты в крови и моче.
Нарушения обмена пуринов
Подагра
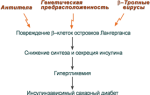
Когда гиперурикемия принимает хронический характер, говорят о развитии подагры (греч. poclos – нога, agra – захват, дословно – “нога в капкане”).
В крови мочевая кислота находится в форме ее солей – уратов натрия. Из-за низкой растворимости ураты способны оседать в зонах с пониженной температурой, например, в мелких суставах стоп и пальцев ног. Накапливающиеся в межклеточном веществе ураты некоторое время фагоцитируются, но фагоциты не способны разрушить пуриновое кольцо. В результате это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов, активации свободнорадикального окисления и развитию острой воспалительной реакции – развивается подагрический артрит . В 50-75% случаев первым признаком заболевания является мучительная ночная боль в больших пальцах ног.
Длительное время подагру считали “болезнью гурманов”, однако затем внимание исследователей переместилось к наследственному изменению активности ферментов метаболизма пуринов:
- увеличение активности ФРДФ-синтетазы – приводит к избыточному синтезу пуринов,
- уменьшение активности гипоксантин-гуанин-фосфорибозил-трансферазы – из-за этого ФРДФ не используется для реутилизации пуриновых оснований, а участвует в первой реакции их синтеза. В результате возрастает количество разрушающихся пуринов и одновременно повышается их образование.
Оба ферментативных нарушения рецессивны и сцеплены с X-хромосомой. Подагрой страдает 0,3-1,7% взрослого населения земного шара, соотношение заболевших мужчин и женщин составляет 20 : 1.
Основы лечения
Диета – снижение поступления предшественников мочевой кислоты с пищей и уменьшение ее образования в организме. Для этого из рациона исключаются продукты, содержащих много пуриновых оснований – пиво, кофе, чай, шоколад, мясные продукты, печень, красное вино. Предпочтение отдается вегетарианской диете с количеством чистой воды не менее 2 л в сутки.
Реакция превращения аллопуринола
К лекарственным средствам лечения подагры относят аллопуринол , по структуре схожий с гипоксантином. Ксантиноксидаза окисляет аллопуринол в аллоксантин, и последний остается прочно связанным с активным центром фермента и ингибирует его. Фермент осуществляет, образно говоря, самоубийственный катализ. Как следствие, ксантин не превращается в мочевую кислоту, и поскольку гипоксантин и ксантин лучше растворимы в воде, то они более легко выводятся из организма с мочой.
Мочекаменная болезнь
Мочекаменная болезнь заключается в образовании солевых кристаллов (камней) разной природы в мочевыводящих путях. Непосредственно образование мочекислых камней составляет около 15% от всех случаев этой болезни. Мочекислые камни в мочевыводящих путях откладываются примерно у половины больных подагрой.
Две переходные формы мочевой кислоты при pH 5,75
Наиболее часто такие камни представлены в дистальных канальцах и собирательных трубочках. Причиной отложения кристаллов мочевой кислоты является гиперурикемия и повышенное выведение уратов натрия с мочой. Главным провоцирующим фактором кристаллизации является увеличение кислотности мочи . При понижении рН мочи ниже 5,75 ураты (енольная форма) переходят в менее растворимую кетоформу и кристаллизуются в почечных канальцах.
Основы лечения
Так же, как при подагре, лечение сводится к беспуриновой диете и использованию аллопуринола . В дополнение рекомендуется растительная диета, приводящая к защелачиванию мочи, что увеличивает в первичной моче долю более растворимых в воде солей мочевой кислоты – уратов. Вместе с этим, уже имеющиеся кристаллы мочевой кислоты (а также оксалатов) способны растворяться при подщелачивании мочи.
Лекарственное лечение непременно должно сопровождаться соблюдением беспуриновой диеты с большим количеством чистой воды, в противном случае неизбежно появление ксантиновых кристаллов в тканях и ксантиновых камней в почках.
Синдром Леша-Нихана
Болезнь Леша-Нихана (частота 1:300000) – это полное врожденное отсутствие активности гипоксантин-гуанин-фосфорибозил-трансферазы , фермента, отвечающего за реутилизацию пуриновых оснований. Признак рецессивный и сцеплен с Х-хромосомой. Впервые его описали в 1964 г в США студент-медик Майкл Леш и педиатр Уильям Нихан.
Дети рождаются клинически нормальными, только к 4-6 месяцу обнаруживаются отклонения в развитии, а именно – отставание физического развития (с трудом держит голову), повышенная возбудимость, рвота, периодическое повышение температуры. Выделение мочевой кислоты можно обнаружить еще раньше по оранжевой окраске пеленок. К концу первого года жизни симптомы нарастают, развивается нарушение координации движений, хореоатетоз, корковый паралич, спазм мышц ног. Наиболее характерный признак заболевания проявляется на 2-3-м году жизни – аутоагрессия или самокалечение – неодолимое стремление детей кусать себе губы, язык, суставы пальцев на руках и ногах.
Синтез Болезниа биохимия
Биохимия — это наука, занимающаяся изучением различных молекул, химических реакций и процессов, протекающих в живых клетках и организмах. Основательное знание биохимии совершенно необходимо для успешного развития двух главных направлений биомедицинских наук: 1) решение проблем сохранения здоровья человека; 2) выяснение причин различных болезней и изыскание путей их эффективного лечения.
БИОХИМИЯ И ЗДОРОВЬЕ
Всемирная организация здравоохранения (ВОЗ) определяет здоровье как состояние «полного физического, духовного и социального благополучия, которое не сводится к простому отсутствию болезней и недомоганий». Со строго биохимической точки зрения организм можно считать здоровым, если многие тысячи реакций, протекающих внутри клеток и во внеклеточной среде, идут в таких условиях и с такими скоростями, которые обеспечивают максимальную жизнеспособность организма и поддерживают физиологически нормальное (не патологическое) состояние.
БИОХИМИЯ, ПИТАНИЕ, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ
Одной из главных предпосылок сохранения здоровья является оптимальная диета, содержащая ряд химических веществ; главными из них являются витамины, некоторые аминокислоты, некоторые жирные кислоты, различные минеральные вещества и вода. Все эти вещества представляют тот или иной интерес как для биохимии, так и для науки о рациональном питании. Следовательно, между этими двумя науками существует тесная связь. Кроме того, можно полагать, что на фоне усилий, прилагаемых к тому, чтобы сдержать рост цен на медицинское обслуживание, все большее внимание будет уделяться сохранению здоровья и предупреждению болезней, т.е. профилактической медицине. Так, например, для предупреждения атеросклероза и рака со временем, вероятно, все большее значение будет придаваться рациональному питанию. В то же время концепция рационального питания должна основываться на знании биохимии.
БИОХИМИЯ И БОЛЕЗНИ
Все болезни представляют собой проявление каких-то изменений в свойствах молекул и нарушений хода химических реакций и процессов. Основные факторы, приводящие к развитию болезней у животных и человека, приведены в табл. 1.1. Все они оказывают влияние на одну или несколько ключевых химических реакций или на структуру и свойства функционально важных молекул.
Вклад биохимических исследований в диагностику и лечение заболеваний сводится к следующему.
Таблица 1.1. Основные факторы, приводящие к развитию болезней. Все они оказывают влияние на различные биохимические процессы, протекающие в клетке или целом организме
1. Физические факторы: механическая травма, экстремальная температура, резкие изменения атмосферного давления, радиация, электрический шок
2. Химические агенты и лекарственные препараты: некоторые токсические соединения, терапевтические препараты и т.д.
3. Биологические агенты: вирусы, риккетсии. бактерии, грибы, высшие формы паразитов
4. Кислородное голодание: потеря крови, нарушение кислородпереносящей функции, отравление окислительных ферментов
5. Генетические факторы: врожденные, молекулярные
6. Иммунологические реакции: анафилаксия, аутоиммунные заболевания
7. Нарушения пищевого баланса: недостаточное питание, избыточное питание
Благодаря этим исследованиям можно 1) выявить причину болезни; 2) предложить рациональный и эффективный путь лечения; 3) разработать методики для массового обследования населения с целью ранней диагностики; 4) следить за ходом болезни; 5) контролировать эффективность лечения. В Приложении описаны наиболее важные биохимические анализы, используемые для диагностики различных заболеваний. К этому Приложению будет полезно обращаться всякий раз, когда будет идти речь о биохимической диагностике различных болезней (например, инфаркта миокарда, острого панкреатита и др.).
Возможности биохимии в отношении предупреждения и лечения болезней кратко проиллюстрированы на трех примерах; позднее в этой же главе мы рассмотрим еще несколько примеров.
1. Хорошо известно, что для поддержания своего здоровья человек должен получать определенные сложные органические соединения — витамины. В организме витамины превращаются в более сложные молекулы (коферменты), которые играют ключевую роль во многих протекающих в клетках реакциях. Недостаток в диете какого-либо из витаминов может привести к развитию различных заболеваний, например цинги при недостатке витамина С или рахита при недостатке витамина D. Выяснение ключевой роли витаминов или их биологически активных производных стало одной из главных задач, которые решали биохимики и диетологи с начала нынешнего столетия.
2. Патологическое состояние, известное под названием фенилкетонурия (ФКУ), в отсутствие лечения может привести к тяжелой форме умственной отсталости. Биохимическая природа ФКУ известна уже около 30 лет: заболевание обусловлено недостатком или полным отсутствием активности фермента, который катализирует превращение аминокислоты фенилаланина в другую аминокислоту, тирозин. Недостаточная активность этого фермента приводит к тому, что в тканях накапливается избыток фенилаланина и некоторых его метаболитов, в частности кетонов, что неблагоприятно сказывается на развитии центральной нервной системы. После того как были выяснены биохимические основы ФКУ, удалось найти рациональный способ лечения: больным детям назначают диету с пониженным содержанием фенилаланина. Массовое обследование новорожденных на ФКУ позволяет в случае надобности начать лечение незамедлительно.
3. Кистозный фиброз — наследуемая болезнь экзокринных, и в частности потовых, желез. Причина болезни неизвестна. Кистозный фиброз является одной из наиболее распространенных генетических болезней в Северной Америке. Он характеризуется аномально вязкими секретами, которые закупоривают секреторные протоки поджелудочной железы и бронхиолы. Страдающие этой болезнью чаще всего погибают в раннем возрасте от легочной инфекции. Поскольку молекулярная основа болезни неизвестна, возможно только симптоматическое лечение. Впрочем, можно надеяться, что в недалеком будущем с помощью технологии рекомбинантных ДНК удастся выяснить молекулярную природу заболевания, что позволит найти более эффективный способ лечения.
ФОРМАЛЬНОЕ ОПРЕДЕЛЕНИЕ БИОХИМИИ
Биохимия, как следует из названия (от греческого bios-жизнь), — это химия жизни, или, более строго, наука о химических основах процессов жизнедеятельности.
Структурной единицей живых систем является клетка, поэтому можно дать и другое определение: биохимия как наука изучает химические компоненты живых клеток, а также реакции и процессы, в которых они участвуют. Согласно этому определению, биохимия охватывает широкие области клеточной биологии и всю молекулярную биологию.
ЗАДАЧИ БИОХИМИИ
Главная задача биохимии состоит в том, чтобы достичь полного понимания на молекулярном уровне природы всех химических процессов, связанных с жизнедеятельностью клеток.
Для решения этой задачи необходимо выделить из клеток многочисленные соединения, которые там находятся, определить их структуру и установить их функции. В качестве примера можно указать на многочисленные исследования, направленные на выяснение молекулярных основ мышечного сокращения и ряда сходных процессов. В результате были выделены в очищенном виде многие соединения различной степени сложности и проведены детальные структурно-функциональные исследования. В итоге удалось выяснить ряд аспектов молекулярных основ мышечного сокращения.
Еще одна задача биохимии заключается в выяснении вопроса о происхождении жизни. Наши представления об этом захватывающем процессе далеки от исчерпывающих.
ОБЛАСТИ ИССЛЕДОВАНИЯ
Сфера биохимии столь же широка, как и сама жизнь. Всюду, где существует жизнь, протекают различные химические процессы. Биохимия занимается изучением химических реакций, протекающих в микроорганизмах, растениях, насекомых, рыбах, птицах, низших и высших млекопитающих, и в частности в организме человека. Для студентов, изучающих биомедицинские науки, особый интерес представляют
два последних раздела. Однако было бы недальновидно совсем не иметь представления о биохимических особенностях некоторых других форм жизни: нередко эти особенности существенны для понимания разного рода ситуаций, имеющих прямое отношение к человеку.
БИОХИМИЯ И МЕДИЦИНА
Между биохимией и медициной имеется широкая двусторонняя связь. Благодаря биохимическим исследованиям удалось ответить на многие вопросы, связанные с развитием заболеваний, а изучение причин и хода развития некоторых заболеваний привело к созданию новых областей биохимии.
Биохимические исследования, направленные на выявление причин заболеваний
В дополнение к указанным выше мы приведем еще четыре примера, иллюстрирующих широту диапазона возможных применений биохимии. 1. Анализ механизма действия токсина, продуцируемого возбудителем холеры, позволил выяснить важные моменты в отношении клинических симптомов болезни (диарея, обезвоживание). 2. У многих африканских растений содержание одной или нескольких незаменимых аминокислот весьма незначительно. Выявление этого факта позволило понять, почему те люди, для которых именно эти растения являются основным источником белка, страдают от белковой недостаточности. 3. Обнаружено, что у комаров — переносчиков возбудителей малярии — могут формироваться биохимические системы, наделяющие их невосприимчивостью к инсектицидам; это важно учитывать при разработке мер по борьбе с малярией. 4. Гренландские эскимосы в больших количествах потребляют рыбий жир, богатый некоторыми полиненасыщенными жирными кислотами; в то же время известно, что для них характерно пониженное содержание холестерола в крови, и поэтому у них гораздо реже развивается атеросклероз. Эти наблюдения навели на мысль о возможности применения полиненасыщенных жирных кислот для снижения содержания холестерола в плазме крови.
Изучение болезней способствует развитию биохимии
Наблюдения английского врача сэра Арчибальда Гаррода еще в начале 1900-х гг. за небольшой группой пациентов, страдавших врожденными нарушениями метаболизма, стимулировали исследование биохимических путей, нарушение которых происходит при такого рода состояниях. Попытки понять природу генетического заболевания под названием семейная гиперхолестеролемия, приводящего к развитию тяжелого атеросклероза в раннем возрасте, способствовали быстрому накоплению сведений о клеточных рецепторах и о механизмах поглощения холестерола клетками. Интенсивное изучение онкогенов в раковых клетках привлекло внимание к молекулярным механизмам контроля роста клеток.
Изучение низших организмов и вирусов
Ценная информация, которая оказалась весьма полезной для проведения биохимических исследований в клинике, была получена при изучении некоторых низших организмов и вирусов. Например, современные теории регуляции активности генов и ферментов сформировались на базе пионерских исследований, выполненных на плесневых грибах и на бактериях. Технология рекомбинантных ДНК зародилась в ходе исследований, проведенных на бактериях и бактериальных вирусах. Главным достоинством бактерий и вирусов как объектов биохимических исследований является высокая скорость их размножения; это существенно облегчает проведение генетического анализа и генетических манипуляций. Сведения, полученные при изучении вирусных генов, ответственных за развитие некоторых форм рака у животных (вирусных онкогенов), позволили лучше понять механизм трансформации нормальных клеток человека в раковые.
БИОХИМИЯ И ДРУГИЕ БИОЛОГИЧЕСКИЕ НАУКИ
Биохимия нуклеиновых кислот лежит в самой основе генетики; в свою очередь использование генетических подходов оказалось плодотворным для многих областей биохимии. Физиология, наука о функционировании организма, очень сильно перекрывается с биохимией. В иммунологии находит применение большое число биохимических методов, и в свою очередь многие иммунологические подходы широко используются биохимиками. Фармакология и фармация базируются на биохимии и физиологии; метаболизм большинства лекарств осуществляется в результате соответствующих ферментативных реакций. Яды влияют на биохимические реакции или процессы; эти вопросы составляют предмет токсикологии. Как мы уже говорили, в основе разных видов патологии лежит нарушение ряда химических процессов. Это обусловливает все более широкое использование биохимических подходов для изучения различных видов патологии (например, воспалительные процессы, повреждения клеток и рак). Многие из тех, кто занимается зоологией и ботаникой, широко используют в своей работе биохимические подходы. Эти взаимосвязи не удивительны, поскольку, как мы знаем, жизнь во всех своих проявлениях зависит от разнообразных биохимических реакций и процессов. Барьеры, существовавшие ранее между биологическими науками, фактически разрушены, и биохимия все в большей степени становится их общим языком.